- Time-Temperature-Transition Diagrams with Liquid Crystalline Phase Changes of Liquid Crystalline Epoxy
Seung Hyun Cho*†
* Department of Materials Science and Engineering, Soong-sil University
- 열경화성 액정 에폭시 수지의 액정상 변화를 포함한 시간-온도-전이 다이어그램
조승현*†
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Liquid crystalline thermosetting epoxy oligomer DD-A was synthesized with Diglycidyl ether of 4,4'-dihydroxy-α-methylstilbene (DGE-DHMS) and aniline in a ratio of 2:1 and cured with a catalytic curing agent, 1-Methyl Imidazole. The gelation times and vitrification times were measured to create Time-Temperature-Transition Diagrams with liquid crystalline phase changes. It was found that the gelation and vitrification times were decreased as the concentration of curing agent increased, and the vitrification curve showing a typical S-shape was confirmed.
Diglycidyl ether of 4,4’-dihydroxy-α-methylstilbene (DGE-DHMS)에 aniline을 2:1의 비율로 첨가한 액정에폭시올리고머인 DD-A를 합성하고 촉매성 경화제인 1-Methyl Imidazole을 이용하여 경화시키며 겔화 및 유리화 시간을 측정하여 액정 변화가 포함된 Time-Temperature-Transition Diagram을 작성하였다. 경화제의 농도가 높아질수록 겔화 및 유리화 시간이 감소함을 확인할 수 있었고 유리화 곡선은 전형적인 S-형태를 보였다
Keywords: 열경화성액정에폭시(Liquid crystalline thermosetting epoxy), 겔화시간(Gelation time), 유리화시간(Vitrification time), 시간-온도-전이 다이어그램(Time-Temperature-Transition Diagram)
열경화성 액정 고분자(Liquid Crystalline Thermosets, LCTs)는 전자패키징이나 비선형 광학(nonlinear optics) 분야에서 뿐만 아니라 고성능 복합재료의 매트릭스 등의 다양한 응용분야에서 우수한 특성을 발휘한다. 열경화성 수지의 경우, 경화 이후에 유용한 특성이 발휘되므로 LCTs에 대한 관심이 증가함에 따라 경화 과정 중의 반응에 대한 이해가 더욱 중요해진다.
지금까지 진행된 열경화성 수지의 등온 경화중의 변화를 보여주는 다이어그램에 관한 연구들은 경화중 물리적 변화에 대한 정보를 제공하지만 액정상의 변화를 보여주지는 못하며, 액정 변화를 보여주는 다이어그램은 겔화 및 유리화와 같은 물리적 변화에 대한 정보는 보여주지 못하고 있는 실정이므로 아직까지는 제한적이라 할 수 있다. 많은 연구자들이 대표적인 열경화성 수지인 epoxy의 경화동역학에 관한 연구를 진행하였고[1-4], Liu 등과 Carfagna 등은 열경화성 액정 에폭시인 Diglycidyl ether of 4,4’-dihydroxy-α-methylstilbene (DGE-DHMS)의 경화동역학에 관한 연구에서 각각 다른 관능기를 갖는 amine류를 경화제로 이용한 결과를 보였다. 단일 관능기를 가진 지방족 또는 방향족 amine이 경화제로 이용된 경우 촉매없이 단순한 동역학 모델로 설명이 가능하였으나 sulfanilamide (SAA)와 같은 4-관능성 amine의 경우 복잡한 양상을 보였다[5,6]. 한편, LCTs에서 가교반응과 액정상의 구조가 어떻게 상호작용하는가에 대한 연구는 많지 않은데 Lin 등은 경화 시간이 증가함에 따라 부분 경화된 LCTs가 isotropic state가 되는데 더 많은 경화시간이 필요함을 보였고[7] Jahromi 등은 LCTs의 겔화가 비액정상인 일반 에폭시와 같은 전환율에서 발생함을 보였다[8].
본 논문에서는 새로운 액정 에폭시 올리고머인 DD-A에 촉매성 경화제로 1-Methyl Imidazole을 사용하여 경화중의 물리적 변화 뿐만 아니라 액정상의 전이 시간에 관한 정보 제공에 도움을 줄 수 있는 온도 및 시간에 따른 액정상의 전이 diagram을 작성하였다.
2.1 합성
다음과 같이 DGE-DHMS를 잘 알려진 방법으로 합성하고[9] 이를 aniline과 반응시켜 DD-A를 합성하였다[10]. Phenol 100 g, chloroacetone 45 mL, dichloromethane 60 mL를 -10oC에서 교반시키고 황산 28 mL를 2시간 동안 천천히 추가한 후 한시간 더 교반하여 얻어진 분홍색의 점도 있는 물질을 얼음물로 충분히 수세하여 잔여 촉매 제거하고 에탄올 및 증류수로 재결정을 반복하여 중성의 생성물을 얻어 여과 후 얻어진 4,4’-dihydroxy-a-methylstilbene (DHMS)를 70oC에서 8시간 이상 진공 건조한다.
4구 플라스크에 진공 건조한 DHMS 20 g, epichlorohydrin 70 mL, isopropanol 56 mL, 증류수 7 mL를 넣고 70oC에서 reflux시키며 20% NaOH 용액을 dropping funnel을 이용하여 천천히 첨가하고 1시간 교반 후 두개의 층으로 분리되면 상층의 물은 제거한다.
반응 종료 후 증류수에 침전시켜 얻어진 백색 파우더를 acetonitrile로 충분히 수세하여 잔여 epichlorohydrin을 제거하고 감압 여과 분리 후 50oC에서 8시간 이상 건조하여 DGE-DHMS를 얻는다. 20 mL의 1,4-Dioxane에 DGE-DHMS 5 g을 가열 및 교반하여 용해시키고, 진공 증류로 정제한 Aniline 0.65 mL를 한 방울씩 첨가한 후 acetic acid 5-7drops를 가하고 120oC에서 2시간 30분간 reflux한 후 차가운 hexane에 부어 침전물을 생성시키고 12시간동안 냉장고에 보관한다. 여과하여 얻어진 침전물을 실온에서 진공 건조하여 생성물을 얻는다.
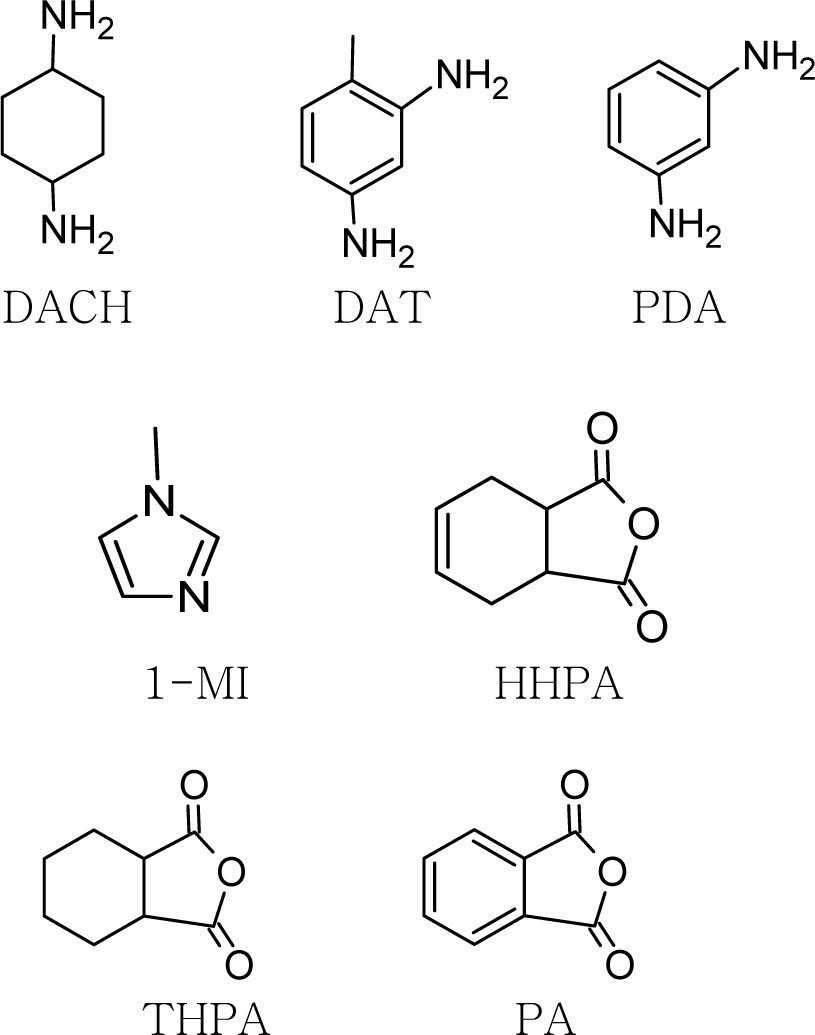
2.2 경화
계량된 DD-A를 60 mL Qorpak bottle에 넣고 가열하여 135°C에서 용융이 시작되면 온도를 110°C로 내린 후 화학양론적인 양(stoichiometric amount)의 경화제를 첨가한다. 완전히 섞이도록 격렬하게 저어준 후 혼합물을 aluminum boat에 부어 냉동보관한다. 적정한 경화제를 선택하기 위해 diamine type의 경화제로 1,4-diaminocyclohexane (DACH), 2,4-Diaminotoluene (DAT) 및 Phenylene diamine (PDA)를 사용하였고, anhydride type의 경화제로 1,2,3,6-tetrahydrophthalic anhydride (THPA), phthalic anhydride (PA) 및 hexahydrophthalic anhydride (HHPA)를 사용하였고 이 때는 0.3 wt% 또는 0.5 wt%의 1-Methyl Imidazole(1-MI)이 촉매로 첨가되었다. 촉매성 경화제로는 1.5 wt%, 2.0 wt% 및 2.5 wt%의 1-Methyl Imidazole이 단독으로 이용되었는데, 3.0 wt% 이상의 1-Methyl Imidazole을 사용한 경우 경화중 시료가 붉게 변색되었다. 사용된 화합물의 구조는 Fig. 1과 Fig. 2에 나타내었다.
2.3 Parallel Plate Rheology
Paar Physica UDS 200, TC 10 Temperature controller 및 상부 25 mm와 하부 50 mm의 parallel plate geometry가 부착된 TEK 600을 이용하여 겔화 및 유리화 시간을 측정하였다.
시료 chamber를 경화온도로 미리 가열한 후 약 1 g의 DDA를 하부 판에 놓은 후 gap이 1 mm가 되도록 상부를 조절하고 1 Hz frequency에서 5% oscillating strain으로 측정을 시작하였다. 겔화 시간은 storage modulus와 loss modulus가 교차하는 시간으로 측정하였고 유리화 시간은 loss modulus curve에서 겔화 이후의 첫 번째 최고점으로 측정하였다.

|
Fig. 1 deal structure of DD-A |
|
Fig. 2 Curing agents |
3.1 경화제의 결정
열경화성 고분자의 최적의 성능은 에폭시 수지가 가교결합에 의해 3차원적으로 불용성 네트워크를 형성한 후에 비로소 얻어지게 되므로 적절한 경화제의 선택이 경화조건, 공정방법 및 물리 화학적 특성 결정에 매우 중요하다. 일반적으로 1,2차 amine류와 anhydride가 가장 많이 사용되는 경화제인데, anhydride와 epoxy의 반응은 매우 느리므로 소량의 3차 amine이나 imidazole을 촉매로 이용한다.
에폭시 경화에 필요한 amine의 화학양론적인 양은 분자량, amine의 활동성 수소(active hydrogen)의 개수 및 에폭시의 EEW(epoxy equivqlent weight)에 의해 결정되므로
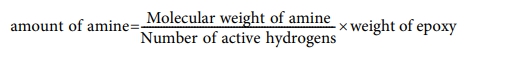
의 식으로 계산하였고 anhydride의 경우는
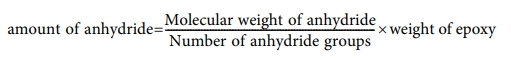
로 계산하였다.
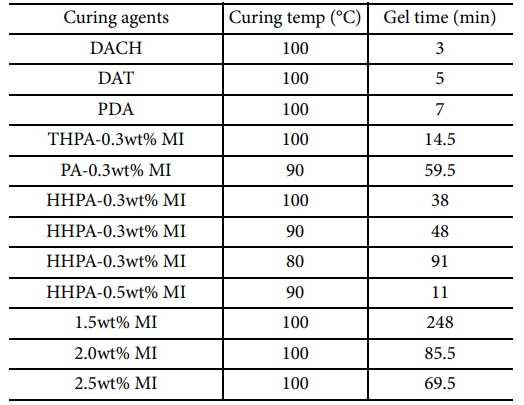
사용된 경화제를 이용하여 측정한 겔화시간은 Table 1과 같다.
경화 온도가 높아질수록 분자의 운동성이 증가하므로 겔화시간이 단축되는 것을 알 수 있으며, anhydride의 경우에서 볼 수 있듯이 같은 온도에서 촉매의 농도가 높을수록 propagation 반응에 참여하는 활동성 분자가 많아지므로 반응속도를 증가시켜 겔화시간이 단축됨을 알 수 있다.
Diamine류의 경화제를 이용한 경우 겔화시간이 너무 짧아서 전이 diagram을 작성하기에 적절하지 못하였다. 또한, 본 연구에서 사용된 amine류 경화제의 경우 4개의 관능기를 가지므로 활동성 수소의 수는 4이고, anhydride류 경화제의 경우 anhydride기의 수는 1이므로 diamine에 비해 4배의 anhydride를 필요로 하는데 이로 인해 에폭시가 희석되어 에폭시가 액정성을 잃는 현상이 발생하였다. 따라서 전이 diagram의 작성에는 촉매성 경화제인 1-Methyl Imidazole을 이용하였다.
에폭시와 1,2차 amine의 경우 단계중합을 통해 경화가 진행되는데 반해, imidazole과 같은 3차 amine의 경우는 연쇄성장중합이 진행된다[11,12]. 특히 imidazole을 이용한 epoxy 경화의 경우 imidazole이 경화반응 중에 재생되는 독특한 경화거동을 보인다는 것이 잘 알려져 있다[11-13].
3.2 전이 diagram
열경화성 물질의 경화과정을 분석 및 디자인하는데에는 시간-온도-전이 다이어그램(time-temperature-transformation diagram, TTT diagram)이 널리 이용된다[14-16].
TTT diagram은 각기 다른 온도에서 겔화 및 유리화 까지의 시간을 표기하는 방식으로 작성되는데, 경화성 물질의 경우 경화후에 유용한 특성이 발현되므로 등온 TTT diagram을 이용하여 액체 상태, 겔화 액체 상태, 유리 상태, 겔화 유리상태 등의 정보를 쉽게 알 수 있다.
등온 경화시 경화성 재료는 액체상태에서 고무상을 지나 유리화하게 되는데 액체상에서 고무로 전이되는 시간이 겔화시간이며 화학적인 경화반응의 활성화에너지 계산에 이용된다.
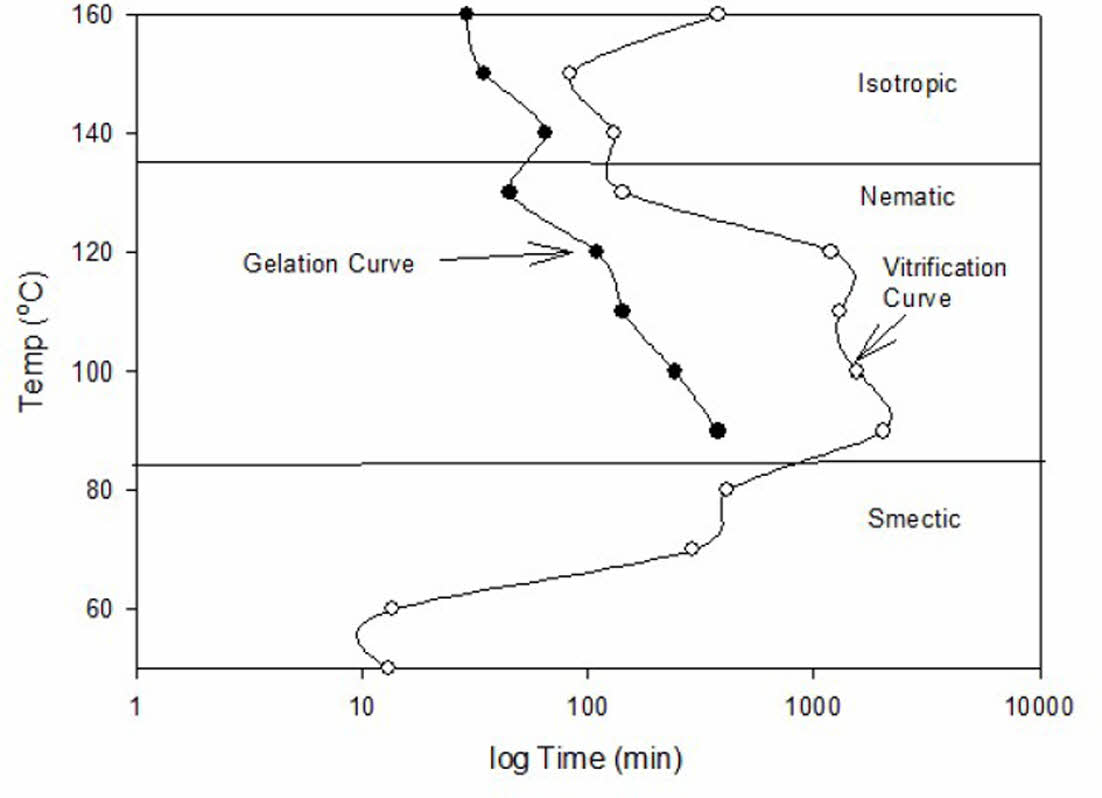
Fig. 3, Fig. 4 및 Fig. 5에 각각 1.5 wt%, 2.0 wt% 및 2.5 wt%의 1-Methyl Imidazole을 이용하여 경화한 DD-A의 TTT diagram을 보였다. closed circle로 표시된 곳이 등온 경화 온도에서 액체상이 겔로 전이되는 겔화 시간(Gelation time)이고 open circle로 표시된 곳이 겔이 유리화 고체로 전이되는 유리화 시간(Vitrification time)이다. 경화제인 MI의 농도가 높아질수록 겔화시간과 유리화 시간이 감소됨을 보여주며, 전형적인 S-형태의 유리화 곡선을 나타냄을 알 수 있다. DD-A/MI system에서는 경화과정중 액정상의 변화 온도가 monomer의 경우와 다르지 않았으며 이전 논문[10]에서 밝힌 바와 같이 83oC에서 smectic 상에서 nematic상으로, 135oC에서 isotropic상으로 전이됨을 반영하여 액정상의 변화를 함께 표시한 TTT diagram을 나타내었다.
|
Fig. 3 TTT Diagram of DD-A/1.5wt% MI system |
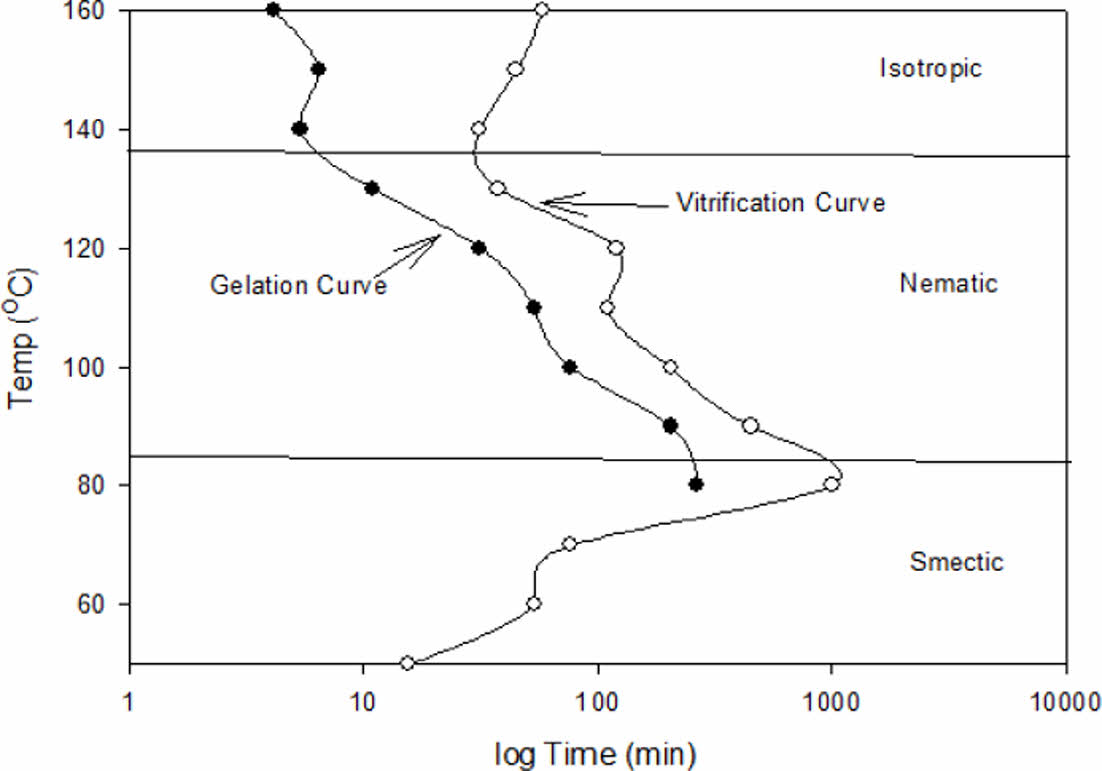
|
Fig. 4 TTT Diagram of DD-A/2.0wt% MI system |
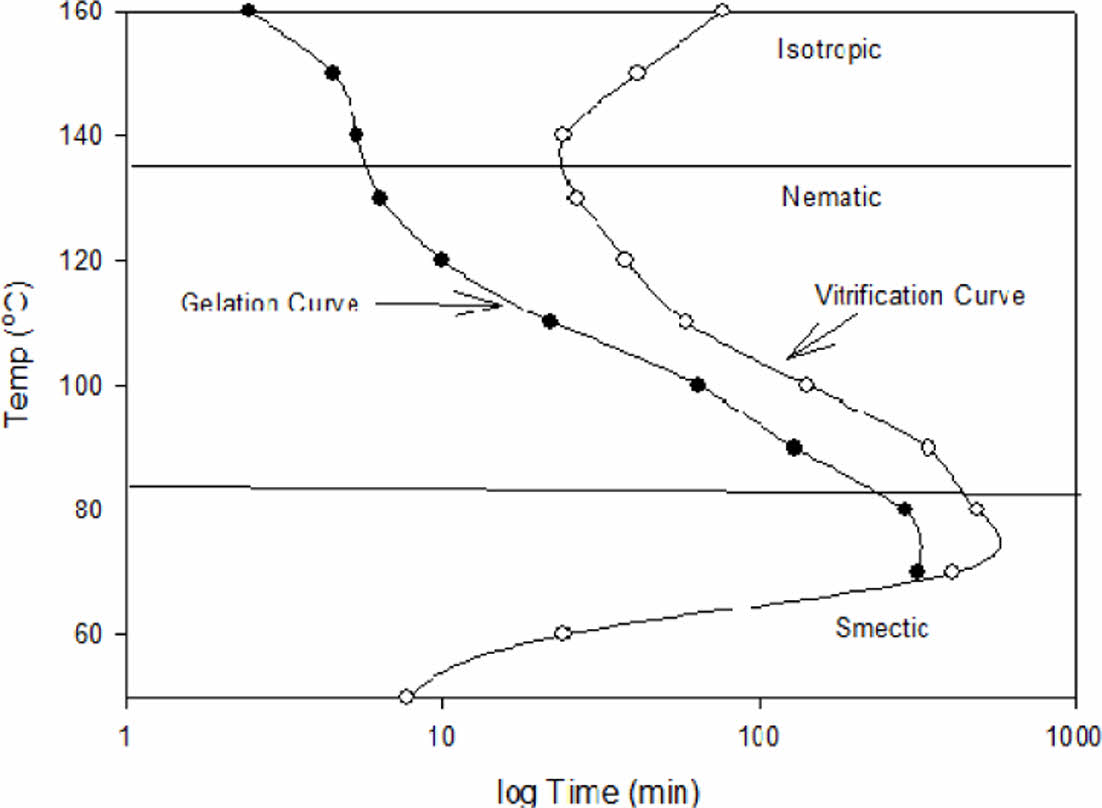
|
Fig. 5 TTT Diagram of DD-A/2.5wt% MI system |
본 연구에서는 열경화성 액정에폭시 DGE-DHMS과 aniline을 이용하여 합성한 DD-A oligomer에 촉매성 경화제인 1-Methyl Imidazole을 사용하여 전이 다이어그램을 작성하였다. 작성된 다이어그램은 경화제의 농도가 높아질수록 겔화 시간 및 유리화 시간이 감소하였으며 전형적인 S-형태의 유리화 곡선을 나타내었다. 각각 다른 온도에서 겔화 및 유리화 시간이 표기되는 전이 다이어그램은 액체상태, 겔화액체상태, 유리 상태, 겔화 유리상태 등의 정보를 한눈에 알 수 있다는 장점이 있는데 본 연구에서는 여기에 액정상의 전이온도 정보를 추가하여 액정상의 변화까지 손쉽게 알아 볼 수 있는 다이어그램을 구성하였다.
향후 추가 연구를 통해 더 많은 다양한 열경화성 액정 고분자들의 액정상 전이 다이어그램을 작성하면 액정고분자를 이용하는 다양한 열경화성 재료의 공정에 많은 도움이 될 것으로 보인다.
- 1. Yu, M., Fu, Q., Zhzng, T., Chen, Y., Tan, J., Zhou, Y., and Zhu, X., “Properties of Curing Kinetics of Epoxy Resin Toughened by Dimer Acid Diglycidyl Ester”, Thermochimica Acta, Vol. 699, 2021, pp. 178910.
-

- 2. Martinez-Miranda, M.R., Garcia-Martinez, V., and Gude, M.R., “Gel Point Determination of a Thermoset Prepreg by Means of Rheology”, Poymer Testing, Vol. 78, 2019, pp. 105950.
-

- 3. Hutchinson, J., and Moradi, S., “Thermal Conductivity and Cure Kinetics of Epoxy-Boron Nitride Composites-A Review”, Materials, Vol. 13, 2020, pp. 3634.
-

- 4. Chai, H., Wang, X., Yang, X., Meng, T., Cheng, Y., and Rehman, W., “Effect of New Nonionic Curing Agent on Curing Kinetics and Mechanical Properties of Epoxy Resin”, Polymers for Advanced Technologies, Vol. 33, 2021, pp. 380-391.
-

- 5. Liu, J., Wang, C., Campbell, G., Earls, J., and Priester Jr., R., “Effects of Liquid Crystalline Structure Formation on the Curing Kinetics of an Epoxy Resin”, Journal of Polymer Science Part A: Polymer Chemistry, Vol. 35, 1997, pp. 1105-1124.
-

- 6. Carfagna, C., Amendola, E., Giamberini, M., Filippov, A., and Bauer, R., “Curing Kinetics of Liquid-crystalline Epoxy Resins”, Liquid Crystals, Vol. 13, 1993, pp. 571-584.
-

- 7. Lin, Q., Yee, A., Sue, H., Earls, J., and Hefner Jr. R., “Evolution of Structure and Properties of a Liquid Crystalline Epoxy during Curing”, Journal of Polymer Science Part B: Polymer Physics, Vol. 35, 1997, pp. 2363-2378.
-

- 8. Jahromi, S., Kuipers, W., Norder, B., and Mijs, W., “Liquid Crystalline Epoxide Thermosets. Dynamic Mechanical and Thermal Properties”, Macromolecules, Vol. 28, 1995, pp. 2201-2211.
-

- 9. Giamberini, M., Amendola, E., and Carfagna, C., “Liquid Cryastellne Epoxy Thermosets”, Molecular Crystals and Liquid Crystals, Vol. 89, 1995, pp. 9-22.
-

- 10. Cho, S., “Thermal Decomposition Energy of Liquid Crystalline Epoxy”, Composites Research, Vol. 37, 2024, pp. 1-6.
-

- 11. Ricciardi, F., Romanchick, W., and Joullie, M., “Mechanism of Imidazole Catalysis in the Curing of Epoxy Resins”, Journal of Polymer Science Part A: Polymer Chemistry, Vol. 21, 1983, pp. 1475-1490.
-

- 12. Ooi, S., Cook, W., Simon, G., and Such, S., “DSC Studies of the Curing Mechanisms and Kinetics of DGEBA Using Imidazole Curing Agents”, Polymer, Vol. 41, 2000, pp. 3639-3649.
-

- 13. Berger, J., and Lohse, F., “Polymerization of p-cresyl Glycidyl Ether Catalyzed by Imidazoles I. The Influence of the Imidazole Concentration, the Reaction Temperature, and the Presence of Isopropanol on the Polymerization”, Journal of Applied Polymer Science, Vol. 30, 1985, pp. 531-546.
-

- 14. Tziamtzi, C., and Chrissafis, K., “Optimization of a Commercial Epoxy Curing Cycle via DSC Data Kinetics Modelling and TTT Plot Construction”, Polymer, Vol. 230, 2021, pp. 124091.
-

- 15. Mangialetto, J., Verhelle, R., Assche, G., Brande, N., and Mele, B., “Time-Temperature-Transformation, Temperature-Conversion-Transformation, and Continuous-Heating-Transformation Diagrams of Reversible Covalent Polymer Networks”, Macromolecules, Vol. 54, 2021, pp. 412-425.
-

- 16. Enns, J., and Gillham, J., “Time-temperature-transformation (TTT) Cure Diagram: Modeling the Cure Behavior of Thermosets”, Journal of Applied Polymer Science, Vol. 28, 1983, pp. 2567-2591.
-

 This Article
This Article
-
2024; 37(3): 215-218
Published on Jun 30, 2024
- 10.7234/composres.2024.37.3.215
- Received on Mar 17, 2024
- Revised on Apr 17, 2024
- Accepted on Apr 28, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Seung Hyun Cho
-
Department of Materials Science and Engineering, Soong-sil University
- E-mail: scho@ssu.ac.kr






 Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.
Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.