- Charge Storage Behavior of the Carbons Derived from Polyvinylidene Chloride-resin and Polyvinylidene Fluoride in Different pH Electrolytes
Sang-Eun Chun*,**†
* School of Materials Science and Engineering, Kyungpook National University, Daegu 41566, Republic of Korea
** Department of Hydrogen & Renewable Energy, Kyungpook National University, Daegu 41566, Republic of Korea- 다른 pH의 전해질에서 polyvinylidene chloride-resin와 polyvinylidene fluoride로부터 합성된 다공성 탄소의 전하 저장 거동
전상은*,**†
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Two polymer precursors, polyvinylidene chloride-resin (PVDC-resin) and polyvinylidene fluoride (PVDF), are assembled into the microporous carbon by pyrolysis. Microporous carbon is advantageous as an electrode for supercapacitors that store electric charges through ion adsorption/desorption. The pyrolysis also turns the various heteroatoms of two precursors into functional groups, contributing to the additional charge storage. The analysis of the porous structure and function group during carbonization are important to develop the carbon for energy storage. Here, we analyzed the functional groups of two polymer-derived carbons through X-ray photoelectron spectroscopy. The electrochemical properties of the functional groups were explored in various pH electrolytes. The specific capacitance of two carbons in the acidic electrolyte (1 M H2SO4) was improved compared to that in the neutral electrolyte (0.5 M Na2SO4) due to the faradaic charge/discharge reaction of the quinone functional group. In particular, the carbon electrode derived from PVDC-resin exhibits a lower capacity than the carbon from PVDF due to the small micropores. In the alkaline electrolyte (6 M KOH), the highest specific capacitance and rate capability were obtained among the three electrolytes for both electrodes based on the facile adsorption of the constituent electrolyte ions (K+, OH-).
Polyvinylidene chloride-resin(PVDC-resin)와 polyvinylidene fluoride(PVDF)의 두 폴리머 전구체는 열분해 과정을 통해 마이크로 다공성 탄소로 변환되어 되므로 이온 흡/탈착으로 전하를 저장하는 슈퍼커패시터용 전극재료로 유리하다. 더욱이, 두 전구체를 구성하는 여러가지 이종원소들은 탄화 후 작용기를 형성하여 추가적인 전하 저장에 기여할 수 있으므로, 탄화 시 생성되는 작용기에 대한 분석은 에너지 저장용 탄소소재를 개발하는데 중요하다. 본 연구에서는 두 폴리머 전구체를 탄화시킨 후 생성된 작용기를 X-선 광전자 분광법(X-ray photoelectron spectroscopy)과 다양한 pH의 전해질에서 탄소 전극의 전기화학 거동 관찰을 통하여 확인하였다. 산성(1 M H2SO4) 전해질에서 측정된 두 탄소 전극의 비전기용량은 생성된 quinone 작용기의 패러데익 충/방전 반응 덕분에 중성 전해질(0.5 M Na2SO4)에서보다 증가하였다. 특히, PVDC-resin으로부터 합성된 탄소는 매우 작은 마이크로 기공이 표면에 형성되어 있어 전해질 이온의 흡착을 어렵게 하므로, PVDF로부터 합성된 탄소 전극에 비해 낮은 용량을 보인다. 염기성 전해질(6 M KOH)에서 두 탄소 전극 모두 3가지 전해질 중 가장 높은 비전기용량이 측정되었는데, 이는 구성하는 전해질 이온들(K+, OH-)이 두 탄소에 형성된 마이크로 기공으로 흡/탈착이 용이하게 일어나는 동시에 패러데익 충/방전 반응으로 추가적인 전하가 저장되었기 때문이다
Keywords: 플루오르화 폴리비닐리덴-레진(Polyvinylidene fluoride-resin (PVDF-resin)), 폴리테트라플루오로에틸렌(Polytetrafluoroethylene (PTFE)), 마이크로기공(Micropore), Na2SO4, H2SO4, KOH
고속 충방전이 가능한 슈퍼커패시터는 높은 출력 특성의 에너지 저장 장치로서, 높은 에너지 밀도를 갖지만 낮은 출력 성능의 배터리를 보완해 줄 수 있는 에너지 저장 장치로서 다양한 응용 분야에 활용되고 있다[1-4]. 슈퍼커패시터가 고속 충방전이 가능한 이유는 전하 저장 반응 메커니즘이 전해질 이온의 전극 표면으로 빠른 흡/탈착 반응에 의해 일어나기 때문이다[2,5,6]. 따라서 넓은 비표면적을 가지는 동시에 전극으로서 필요한 전기전도성을 갖는 활성탄 소재가 주로 전극 소재로서 활용된다[7-9]. 활성탄의 합성은 일반적으로 유기물 전구체의 탄화와 이어서 기공을 생성하는 활성화 과정의 2단계를 거쳐야 하므로 복잡한 공정 시설과 비용이 추가된다[7]. 기존의 유기물 전구체(식물군, 동물군)들과 달리 탄소 주사슬(backbone)에 다양한 이종원소(hetero-atom)들이 결합된 구조의 폴리머 소재(예, polyvinylidene chloride(PVDC), polyvinylidene fluoride (PVDF) 등)들은 열분해 과정에서 고리형 분자구조(aromatic)구조의 그래핀 층(graphene layer)이 적층된 구조를 형성함과 동시에 이종원소들의 방출에 의해 다수의 기공을 생성한다. 따라서, PVDC와 PVDF와 같은 폴리머 전구체들은 간단한 열분해 과정을 통해 다공성 탄소로 변환되므로 슈퍼커패시터용 고비표면적의 전극으로 최근 각광받고 있다[10-13].
PVDC와 PVDF 전구체는 비교적 손쉽게 다공성 탄소를 합성할 수 있다는 장점이 있으나, 기존 전극재료로 널리 활용되고 있는 코코넛 기반의 다공성 활성탄에 비하면 비표면적이 1,000 m2 g-1 이하로 다소 낮다[10,14,15]. 따라서 실제 상용 슈퍼커패시터용 전극 재료로 사용되기 위해서는 추가적인 기공 생성을 필요로 한다[16,17]. 추가적인 기공 생성 공정의 도입은 활성탄 제조 비용을 상승시키므로, 한번의 공정으로 손쉽게 다공성 탄소 합성이 가능한 전구체로서의 장점을 감소시킨다. 상용으로 구입 가능한 PVDC-resin은 주성분인 탄소 이외에도 H, Cl와 N 등의 원소로 구성되어 있다. 열분해 과정 중 탄소이외의 이종 원소들은 다양한 작용기를 형성할 수 있다[18]. 탄소에 존재하는 O또는 N를 포함하는 작용기는 전극으로 사용시 전하 전달의 패러데익(faradaic) 반응으로 전하 저장이 가능하다[19]. 따라서, 폴리머 전구체로부터 합성된 탄소 전극은 이온 흡착에 의한 capacitive 충전 이외에도 추가적인 패러데익 반응에 의해 비전기용량의 향상이 기대된다[20,21]. PVDF 전구체 또한 열분해 과정에서 패러데익 반응을 하는 작용기가 생성된다면 낮은 비표면적에 의한 낮은 비전기용량을 상승시킬 수 있다. 따라서, 두 폴리머 전구체로부터 합성된 다공성 탄소를 슈퍼커패시터용 전극으로 활용하기 위해서는 열분해 후 형성된 기공 구조와 함께 생성된 작용기의 분석이 필수적이다. 특히, 생성된 작용기에서 추가적인 전하 저장 반응이 일어날 수 있도록 탄소 전극에서 패러데익 충/방전 반응을 나타나는 전해질의 선정이 필요하다.
탄소 전극에 생성된 작용기의 종류 및 분율은 일반적으로 X-선 광전자 분광법을 통하여 가능하다[22]. 탄소 소재에 존재하는 다양한 작용기는 전해질에 존재하는 이온의 종류(H+, OH-)에 따라 패러데익 반응의 여부가 결정된다. 즉, 탄소에 존재하는 작용기가 함께 전해질내 존재하는 이온들과 반응하여 패러데익 반응을 하는 경우 추가적인 전하 저장 반응으로 전극의 비전기용량이 향상된다. 따라서, 다른 pH의 전해질들은 구성하는 이온의 종류가 달라지므로, 다양한 전해질에서 탄소 전극의 전기화학 거동 분석을 통해서 형성된 작용기의 분석이 가능하다. 게다가 실용적인 관점에서 작용기의 패러데익 반응에 의한 에너지 저장 용량의 향상 확인이 가능하다. 즉, 폴리머 전구체의 열분해로부터 합성한 탄소 전극을 다양한 전해질에서 전기화학 거동 분석을 통하여 열분해 동안 형성된 작용기의 종류와 작용기에 의한 비전기용량의 향상을 측정할 수 있다.
본 연구는 탄소를 주사슬로 하며 이종원소가 결합된 두 가지 전구체(PVDC-resin, PVDF)를 열분해하여 탄화된 폴리머가 슈퍼커패시터용 전극 재료로 사용 가능성을 분석하였다. 특히, 두 폴리머 전구체는 이종원소가 열분해 중 방출되어 무수히 많은 마이크로 크기의 기공을 갖는 다공성 탄소를 형성하므로 넓은 비표면적 덕분에 이온 흡/탈착에 유리한 구조이므로 커패시터용 전극재료로 유망하다. 하지만, 이온 흡/탈착에 의한 전하 저장 용량은 전극재료로 사용하기에 충분하지 않다. 그러나, 전구체에 존재하는 다양한 이종 원소들은 열분해 과정 후 탄소 소재내에서 다양한 형태의 작용기로 변화하여 사용하는 전해질에 따라 패러데익 반응이 일어나 전극의 용량 향상에 기여할 수 있다. 따라서, PVDC-resin과 PVDF 전구체로부터 합성된 탄소를 슈퍼커패시터용 전극재료로 활용하기 위해서는 유도된 다양한 작용의 종류를 밝혀내고 어떠한 전해질에서 전하 저장 반응에 기여하는지 연구할 필요가 있다. 본 연구는 다양한 pH를 갖는 전해질을 활용하여 두 폴리머 전구체로부터 유도된 탄소의 작용기 반응을 통해 전하 저장 거동에 대해 분석하였다. 다양한 전해질에서의 전극들의 전기화학 거동 비교를 통해 에너지 저장 성능이 높은 전극과 전해질을 찾고 우수한 에너지 저장 재료에 대해 토론하였다.
2.1 Material preparation
다공성 탄소를 합성하기 위한 전구체 물질로써 두 가지 종류의 폴리머 polyvinylidene chloride-resin(PVDC-resin; F216, Asahi Kasei)와 polyvinylidene fluoride(PVDF; Sigma-Aldrich Inc.)를 사용하였다. PVDC-resin과 PVDF전구체는 탄소 주사슬에 이종원자 가 결합되어 있는 형태로 열분해를 통해 탄화(carbonization)된다. 열분해 공정을 위하여 수평 튜브 전기로를 이용하여 질소 기체를 흘려주며(유량: 300 cm3 min-1) 700oC의 조건에서 2시간 열처리하였다. PVDC-resin 전구체는 N2 분위기에서 600oC 열처리시 결합된 수소가 방출되면서 나노크기의 기공이 생성된다[13]. 따라서 본 연구에서는 700oC에서 열처리를 통하여 기공을 갖는 탄소를 합성하였다. 등온 구간까지의 상승 속도와 실험 후 상온으로 하강 속도는 5oC min-1으로 고정하였다. 합성된 탄소는 추가적인 정제과정 없이 전극 활물질로 활용하였고 PVDC-resin과 PVDF로부터 합성된 샘플들은 각각 PVDC-carbon과 PVDF-carbon으로 명명되었다.
2.2 Material characterization
전계 방출 주사현미경(FE-SEM; SU9220, Hitachi, Japan)을 이용하여 5 kV의 가속 전압과 10 mm의 작동 거리에서 합성된 탄소 샘플들의 표면 형상 및 입자 크기를 관찰하였다. 각 탄소 샘플들의 비표면적, 전체 기공 부피, 기공 분포도 측정을 위하여 기체 흡착기(gas sorption analyzer)를 사용하여 N2 기체의 전극 표면으로 흡/탈착량을 상대압력을 달리하여(P/P0) 측정하였다. 기체 흡착 실험 전 탄소 샘플 표면에 흡착되어 있는 물 분자 또는 불순물을 제거하기 위하여 300oC에서 3 h 동안 진공 분위기에서 열처리하여 탈기(degas)하였다. 탈기 후 탄소 샘플들에 대해 측정된 N2 등온 흡착곡선(isotherm)으로부터 multi-point Brunauer-Emmett-Teller(BET) 이론을 바탕으로 비표면적을 계산하였다. 제조된 탄소의 전체 기공 부피(total pore volume)는 N2 기체의 상대 기압(P/P0) = 0.95 부근에서의 N2 흡착량으로 부터 구하였다. 기공의 크기 별 분포는 Quenched solid density functional theory(QSDFT) 계산 모델을 이용하여 얻었다. 합성된 탄소를 구성하는 조성과 생성된 작용기(functional groups) 분석을 위하여 X-선 광전자 분광 분석기(X-ray photoelectron spectroscopy)(XPS; Quantera SXM, ULVAC-PHI, Japan)를 사용하였다. XPS 분석기는 단색(monochromatic) Al Kα X-ray source(24.6 W)를 사용하였다. survey 스캔 모드로 측정한 스펙트럼으로부터 탄소의 구성 원소 성분을 분석하였고, high resolution 스캔 모드에서 얻은 스펙트럼으로부터 탄소 샘플에 존재하는 다양한 작용기(functional group)를 분석하였다.
2.3 Electrochemical measurement
합성된 샘플들의 전기화학적 거동 및 성능 분석을 위해서 합성된 탄소 샘플을 활물질로 하는 전극을 제조하였다. 샘플은 polytetrafluoroethylene(PTFE)(particle size < 350 μm) 바인더 및 전도성 탄소인 carbon black(KETJENBLACK EC-600JD, AkzoNobel)과 함께 85 : 10 : 5의 질량비로 마노유발(agate mortar)과 마노유봉(agate pestle)을 이용하여 물리적으로 혼합하여 전극 물질을 준비하였다. 전기화학 실험은 삼 전극 셀(three-electrode cell)의 반쪽 전지 형태(half-cell set-up)로 구성하였다. 작동 전극(working electrode)으로 합성된 탄소 전극을 사용하였으며 상대 전극(counter electrode)으로 코일 백금선(coiled platinum wire)을 사용하였다.
다양한 pH의 전해질에서 전극의 전기화학 거동 관찰을 위하여 3가지 전해질을 사용하였다. 중성 전해질로서 0.5 M Na2SO4(ACS, 99.0%, Alfa Aesar)용액을 준비하였고, 산성 전해질로 1 M H2SO4(98%, DAEJUNG) 용액을 염기성 전해질로 6 M KOH(pellets, 85%, Alfa Aesar) 용액을 사용하였다. 사용하는 전해질에 따라 포텐셜 측정을 위한 기준 전극(reference electrode)을 달리하였으며, 산성과 중성 전해질에서는 saturated calomel electrode(SCE; -0.241 V vs. normal hydrogen electrode(NHE))를 사용하였고 측정된 포텐셜 값은 다음 식으로부터 NHE를 기준으로 표시하였다(ENHE = ESCE + 0.241 V). 염기성 전해질에서는 기준 전극으로 mercury/mercury oxide electrode(Hg/HgO; -0.098 V vs. NHE)를 사용하였고, 측정된 포텐셜 값은 NHE를 기준으로 나타내었다(ENHE = EHg/HgO + 0.098 V). 전기화학 실험 시 전극 기판에서의 부반응을 막기 위해서 중성과 염기성 전해질에서는 전극 기판소재로 nickel mesh를 사용하였고, 산성 전해질의 경우에는 stainless steel mesh를 사용하였다.
탄소 전극의 비전기용량(specific capacitance) 및 고출력 조건에서의 율속 특성(rate capability)을 측정하기 위하여 cyclic voltammetry 방법으로 전압 주사속도를 달리하여(5 mV s-1, 10 mV s-1, 20 mV s-1, 50 mV s-1) 반응 전류를 측정하였다. 비전기용량은 가장 느린 주사속도인 5 mV s-1에서의 voltammogram으로부터 측정하였다. 전극과 전해질 계면에서의 전기화학 반응 분석을 위하여 전기화학 임피던스 분광법(electrochemical impedance spectroscopy; EIS)을 실시하였고 개회로 전압(open circuit potential)조건에서 5 mV 진폭의 사인 파형(sine wave)을 가하여 1000 kHz-0.1 Hz의 주파수 범위에서 실시하였다.
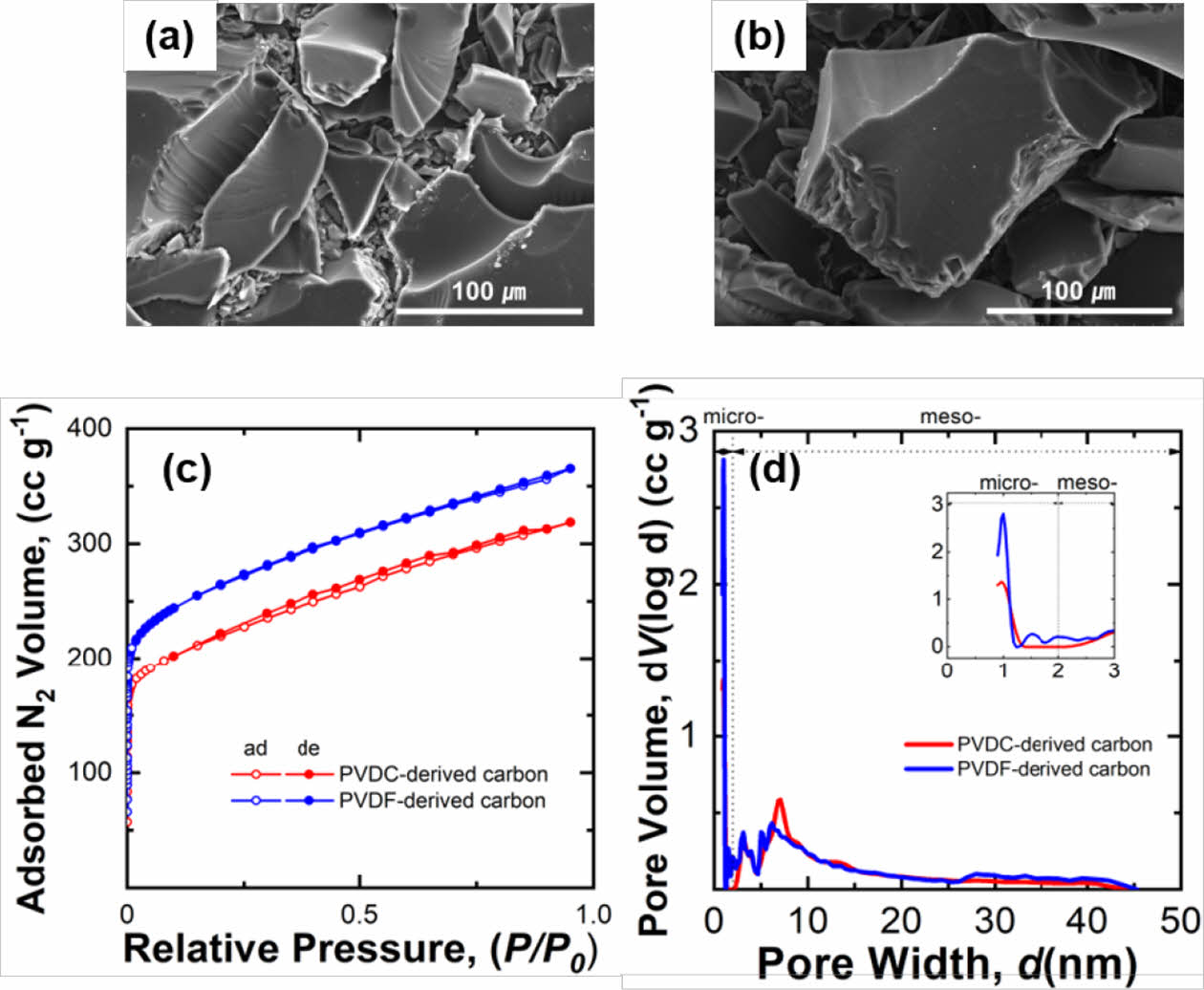
두 폴리머 전구체인 PVDC-resin과 PVDF로부터 유도된 탄소의 표면 형상을 FE-SEM으로 관찰한 결과 유도된 탄소는 모두 수백 μm의 분말들로 모두 매끈한 표면을 갖는 것이 관찰되었다(Fig. 1a-b). PVDC-resin 전구체는 탄소 원소로 구성된 주사슬을 갖고 H와 Cl가 매달려있는 화학 결합을 갖고 있으며, PVDF 또한 유사한 형태의 탄소 주사슬에 H와 F가 결합된 구조를 갖고 있다. 두 폴리머 전구체를 열처리 하는 동안 주사슬에 연결된 원소들은 기체의 형태로 방출되며 남은 자리가 기공으로 역할을 하여 다공성의 탄소가 형성된다[23]. 탄화 과정에서 두 전구체의 기공 형성 반응이 일어남에도 불구하고 표면에서 기공이 관찰되지 않은 것을 볼 때 탄화과정에서 생성되는 기공들은 대부분 작은 크기의 마이크로 기공(지름 < 2 nm) 또는 메조 기공(2 nm < 지름 < 50 nm)들이 대부분 생성된다고 생각된다.
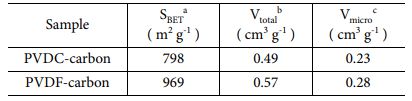
합성된 탄소에 생성된 기공들을 정량적으로 분석하기 위하여 두 탄소 샘플(PVDC-carbon, PVDF-carbon)에 대해서 N2 흡/탈착 곡선을 측정하였고, 흡탈착 결과부터 기공의 크기 별 분포를 계산하였다(Fig. 1c-d and Table 1). 두 샘플들의 등온 흡착곡선(isotherm)은 유사한 경향을 보였다(Fig. 1c). 즉, 낮은 상대 압력범위(0 < P/P0 < 0.1)에서 흡착량이 급격히 증가하고 이후 서서히 증가하는 흡착량을 보여주었다[24]. 초기 급격한 흡착량 증가는 N2기체가 탄소 표면의 마이크로 기공으로 흡착하며 나타나는 것으로 두 탄소에 존재하는 기공 대부분은 마이크로 기공으로 구성된 것을 알 수 있다. 중간 상대압력 범위에서 흡/탈착 곡선사이의 이력곡선(hysteresis loop)이 거의 나타나지 않는데 이는 메조 기공량이 매우 낮음을 의미한다(Fig. 1c)[25]. 등온 흡착곡선으로부터 QSDFT 방법으로 재구성한 기공 크기 별 분포(pore size distribution)도를 보면 두 탄소샘플내 대부분의 기공은 micro 크기의 기공임을 알 수 있다(Fig. 1d). 두 샘플의 기공분포도를 비교해보면 PVDF-carbon에 생성된 마이크로 기공양이 PVDC-carbon에 형성된 micropore 양보다 더 많은 것을 알 수 있으며 이는 비표면적 및 전체 형성된 기공 양의 향상에 기여하였다(Fig. 1d and Table 1).
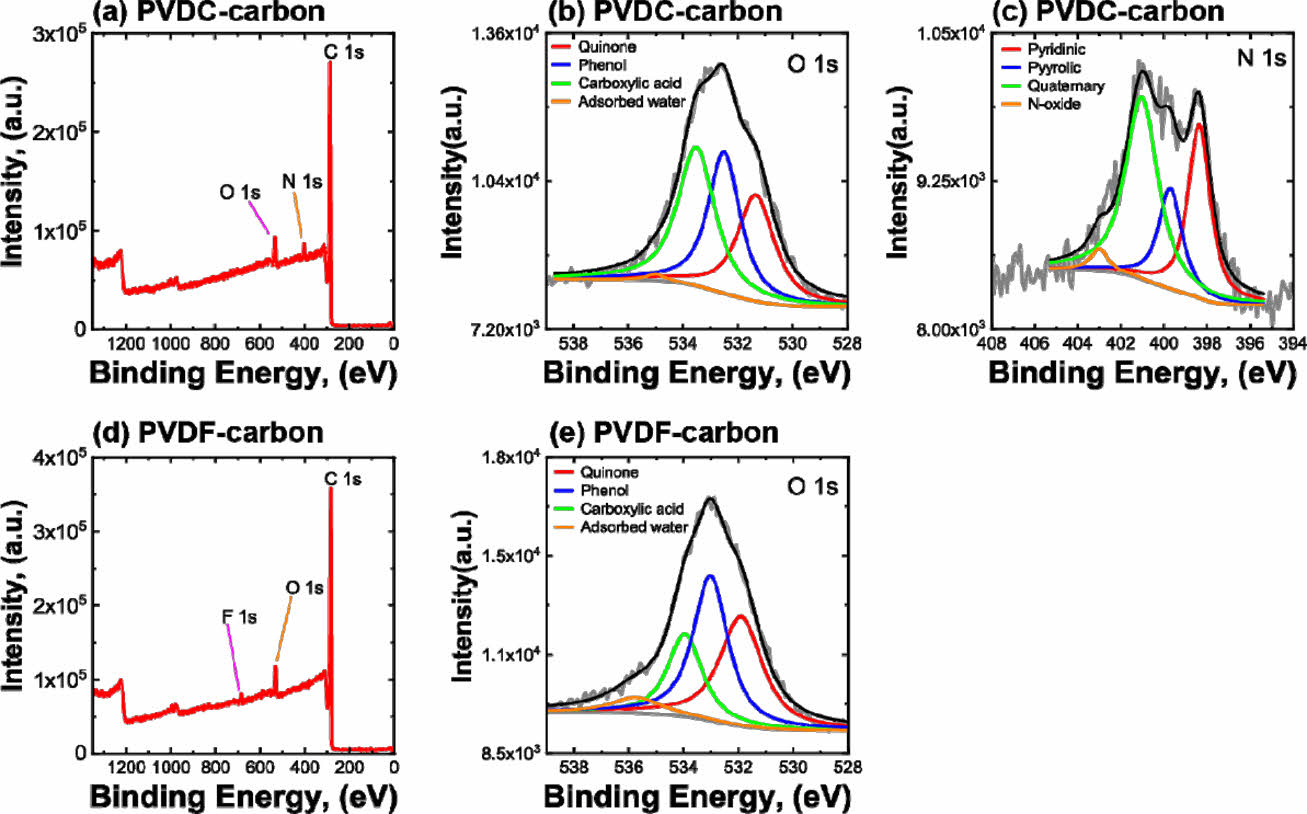
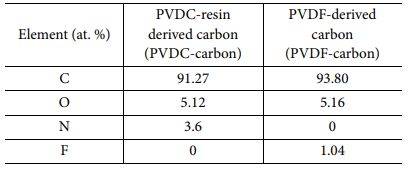
합성된 두 탄소를 구성하는 원소의 비율과 O, N을 포함하는 작용기의 분율을 분석하기 위하여 XPS 분석을 실시하였다(Fig. 2 and Table 2). PVDC-carbon 샘플은 탄소 이외에도 O와 N이 존재하였는데, 그 이유는 순수한 PVDC 가 아닌 resin이 첨가된 PVDC 전구체가 사용되었기 때문이다 (Fig. 2a and Table 2). 따라서, PVDC-carbon에는 O 또는 N을 포함하는 작용기가 존재할 것으로 생각된다. 한편, PVDF-carbon의 경우에는 탄소 이외에 O와 F가 확인되었다(Fig. 2d). 따라서, PVDF-carbon 샘플의 경우에는 패러데익 반응을 하는 작용기는 O를 포함하는 작용기만 생성될 것으로 기대된다(Fig. 2a and Table 2).
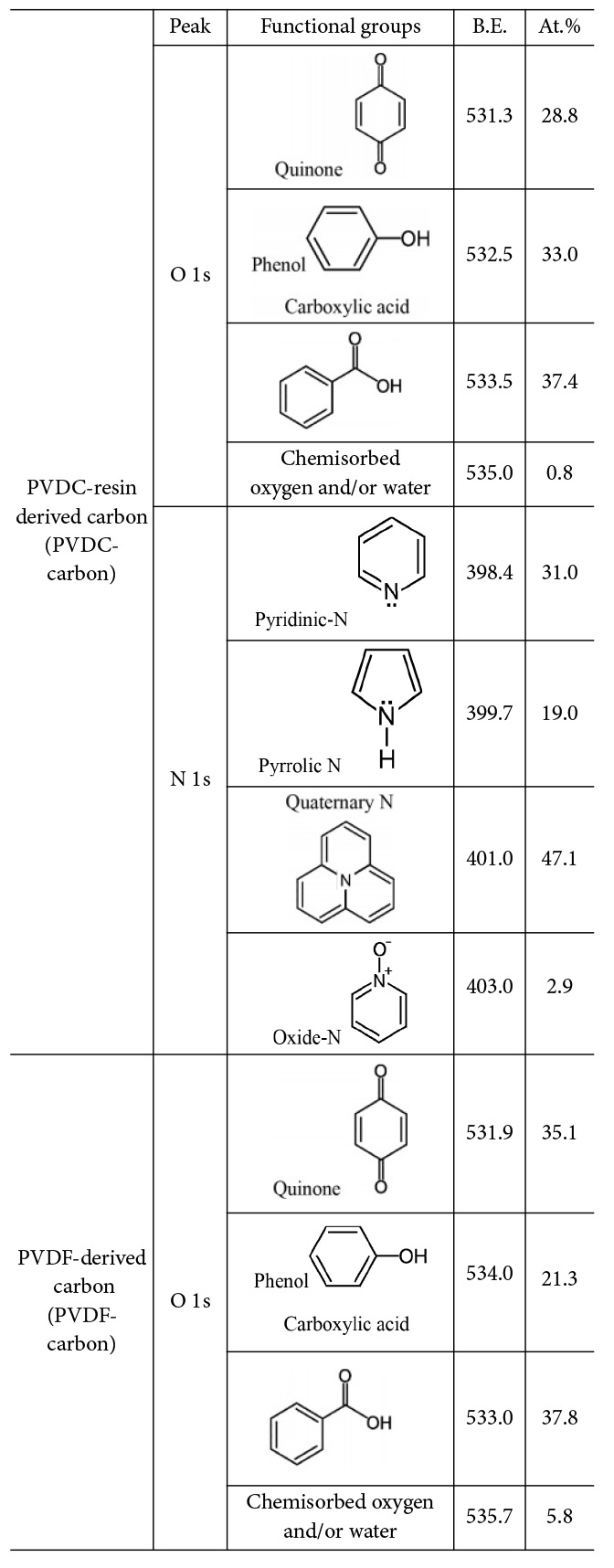
탄소에 존재하는 작용기의 비율은 작용기를 포함하는 원소의 고해상도 스캔으로부터 구하였다(Table 3). PVDC-resin로부터 유도된 탄소에서 O와 N을 포함하는 작용기가 전기화학 성능에 기여할 것이므로 O 1s 피크와 N 1s 피크를 고해상도 스캔으로부터 구하였고 O를 포함하는 작용기는 carboxyl acid, phenol and/or ether, quinone, chemisorbed oxygen and/or water 순서의 비율로 존재하는 것이 확인되었다. 한편, N을 포함하는 작용기는 N 1s 피크의 deconvolution으로부터 분석하였고, quaternary N, pyridinic N, pyrrolic and/or pyridine N, oxide N 순서의 비율로 존재하는 것이 확인되었다. PVDF로부터 유도된 탄소의 경우에는 O포함 작용기는 carboxyl acid, quinone, phenol and/or ether, chemisorbed oxygen and/or water 순의 비율로 존재하였다. PVDC-carbon과 달리 N을 포함하는 작용기는 존재하지 않았다. 합성된 두 샘플 모두 O를 포함하는 작용기로 carboxyl acid가 제일 많이 존재하며, PVDC-carbon에서는 phenol이 두 번째로 많이 존재하고 PVDF-carbon에서는 quinone이 두 번째로 많이 존재하였다.
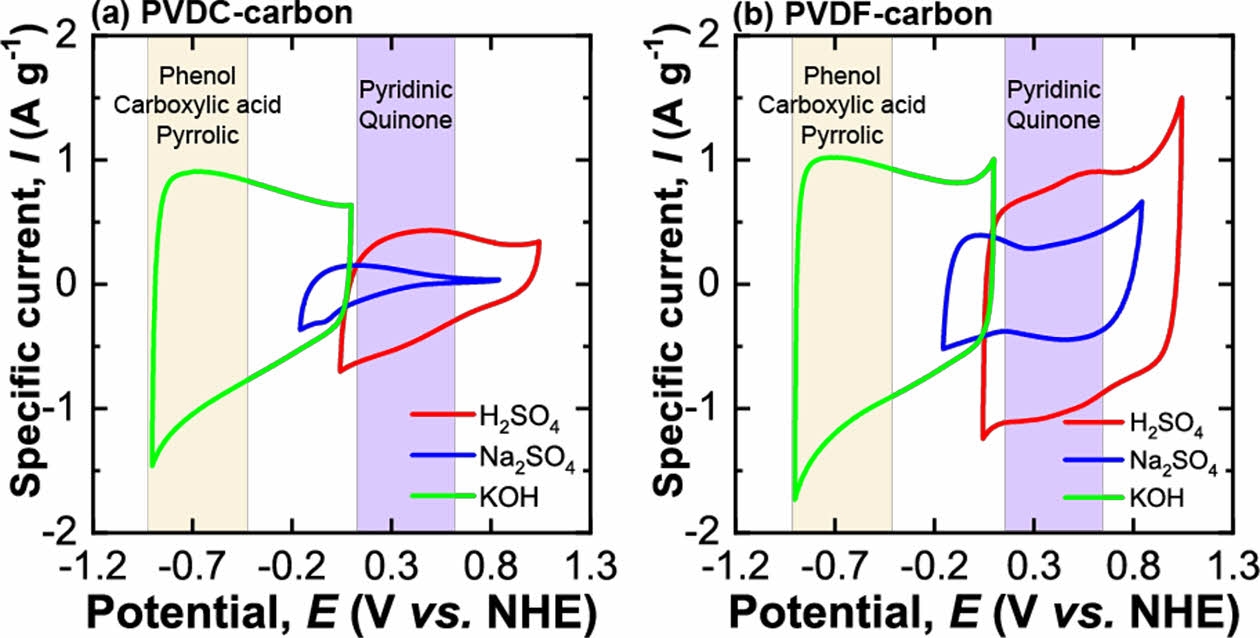
합성된 탄소 전극에 존재하는 작용기에 따라 전기화학적 거동의 차이를 분석하기 위하여 다른 pH의 3가지 전해질(6 M KOH, 0.5 M Na2SO4, 1 M H2SO4)에서 cyclic voltammogram 전기화학 실험을 실시하였다(Fig. 3). 두 가지 탄소 모두에서 가장 높은 비율을 갖는 O 작용기인 carboxyl acid는 염기성 전해질에서 산화환원의 패러데익 반응을 일으키며 산성 전해질에서는 반응하지 않는다[26]. 따라서, 합성된 두 탄소 전극은 염기성 전해질인 KOH 용액에서 capacitive 충전 반응 이외에도 패러데익 반응으로 추가적인 전하 저장을 할 것으로 생각된다. 한편, PVDC-carbon 샘플의 O 작용기 중 두 번째로 높은 비율의 phenol groups 역시 염기성 전해질에서 패러데익 반응을 일으키고 산성 용액에서는 산화환원 하지 않는다. 반면, PVDF-carbon 샘플에서 두 번째로 높은 비율의 O 작용기인 quinone은 산성 전해질에서만 패러데익 반응을 한다[27]. 따라서, PVDF-carbon 전극은 산성 전해질에서 이온 흡/탈착의 capacitive 충전 이외에도 추가적인 패러데익 반응으로 전하를 저장할 것으로 기대된다.
PVDC-carbon 샘플은 N 작용기를 포함하고 있으며 그 중 Quaternary-N의 비율이 가장 높았다. Quaternary-N과 함께 oxide-N은 전하 저장의 패러데익 반응에는 관여하지 않지만, 전극의 전기 전도성을 증가시켜 주므로 전극내 전자의 이동을 원활하게 해준다[28]. N 작용기 중 두 번째로 높은 비율의 pyridinic-N은 산성 용액에서 패러데익 반응을 하고, 세 번째로 높은 비율인 pyrrolic-N은 알칼리 용액에서 패러데익 반응을 한다.
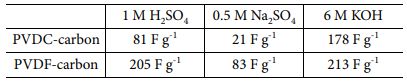
전극에 존재하는 다양한 작용기들에 따라 전기화학 거동의 변화를 살피기 위하여 다양한 pH의 전해질에서 두 탄소 전극에 대해 cyclic voltammetry를 측정하였다(Fig. 3). 다양한 전해질에서 측정된 두 탄소 전극의 비전기용량은 Table 4에 정리하였다. PVDC-carbon과 PVDF-carbon 샘플은 각각 798 m2 g-1과 969 m2 g-1의 비슷한 비표면적을 가짐에도 불구하고 Na2SO4 전해질에서 PVDF-carbon 샘플이 약 4배 높은 용량을 보였다. PVDC-resin으로부터 유도된 탄소 전극에 낮은 비전기용량을 보이는 이유는 넓은 비표면적에도 불구하고 탄소에 존재하는 많은 양의 작은 마이크로 기공 때문인 것으로 생각된다(Fig. 1b). Na2SO4 전해질에서의 voltammogram을 보면 양의 분극에서 반응 전류 값이 매우 낮은 것이 확인되는데 이는 큰 크기의 SO42- 이온이 전극 표면에 거의 흡착되지 않는 것을 의미하며, 표면에 존재하는 작은 기공이 사면체 구조의 큰 크기의 SO42- 이온의 출입을 어렵게 하였기 때문으로 생각된다.
산성 H2SO4 전해질에서 두 탄소 전극의 비 전기용량은 모두 중성 전해질에서의 비 전기용량보다 향상되었다(Table 4). 특히, 두 전극의 voltammogram 모두 0.43 V(vs. NHE) 부근에서 산화/환원 반응의 피크를 보여주었다(Fig. 3a-b). 0.43 V(vs. NHE) 부근의 산화/환원 피크는 quinone/hydroquinone의 redox 반응 때문이며 합성된 두 탄소 모두에 높은 비율로 존재하는 quinone 작용기가 전해질내 높은 농도의 H+ 이온과 반응하여 추가적인 패러데익 반응으로 전하 저장에 기여했기 때문으로 생각된다[29]. PVDC-carbon 샘플내 pyridine-N 작용기도 산성 전해질에서 패러데익 반응을 하므로, 전하 저장에 기여를 한 것으로 생각된다[26]. PVDC-carbon내 존재하는 N 작용기가 전하 저장에 기여함에도 측정된 비전기용량이 PVDF-carbon 보다 더 낮은 값을 가지는 이유는 합성된 탄소에 존재하는 ultra-micropore 때문으로 생각된다. 즉, H2SO4 전해질 내 SO42- 이온이 전극표면의 작은 기공으로 인해 흡/탈착하기 어려웠기 때문으로 생각된다(Fig. 3a). H2SO4 전해질에서 PVDC-carbon 샘플의 voltammogram 개형은 Na2SO4 전해질에서의 그래프 개형과 상당히 유사하게 나타나며, 표면의 ultra-micropore로 인해 이온 흡착이 어려울 것이라는 가설을 뒷받침한다(Fig. 3a)[30].
한편, 알칼리 전해질인 KOH용액에서는 H2SO4전해질과는 달리 뚜렷한 산화/환원 피크가 관찰되지 않았다(Fig. 3). KOH 용액에서 측정된 반응 전류가 비교적 평탄하게 나타나는 이유는 패러데익 반응이 일어나는 화학 반응 메커니즘이 다르기 때문으로 생각된다[31]. PVDC-carbon에 높은 분율로 존재하는 O 작용기인 carboxylic acid와 phenol은 KOH 전해질에 존재하는 OH- 이온과 패러데익 반응으로 전하를 저장한다[19]. 두 전극 모두 KOH 용액에서는 H2SO4전해질에서보다 측정된 비전기용량이 더 높게 나타났는데 그 이유는 두 탄소 샘플 모두 phenol과 carboxyl acid 같이 염기성전해질에서 반응하는 작용기의 비율이 산성전해질에서 작용하는 작용기인 quinone보다 크기 때문에 염기성 전해질에서 높은 용량이 나타나는 것으로 생각된다(Fig. 3). PVDC-carbon에 존재하는 pyrrolic-N 또한 염기성 전해질에서 전하저장반응에 기여하였기 때문으로 해석된다.
KOH 전해질에서 높은 비전기용량이 나타나는 또 다른 이유는 KOH 전해질 이온들의 전극표면으로 흡착 반응이 다른 전해질에 비해 쉽게 일어났기 때문으로 생각된다. Voltammogram에서 양의 분극의 높은 반응 전류는 음이온의 흡착이 전극 표면으로 쉽게 일어났다는 것을 의미한다. 산성, 중성 전해질에 존재하는 3차원 구조인 SO42- 이온의 수화된 크기(hydration ion size)보다 1차원 선형 구조인 OH-의 수화이온의 크기가 작아서 작은 기공으로의 흡착이 용이하다[32]. 게다가, H+와 OH- 이온은 용매인 H2O에서 proton hopping 과정으로 통해 H3O+ 상태로 이동하여 다른 이온에 비해 매우 큰 이온전도도를 가지므로 전하저장 용량을 높일 수 있다[33]. 양이온의 이온 전도도의 경우 K+ 이온(73.5 S cm2 mol-1)이 Na+ 이온(50.11 S cm2 mol-1)보다 더 높아 전하저장 반응을 향상시키므로 K+ 이온 또한 비전기용량 향상에 기여한 것으로 생각된다[33].
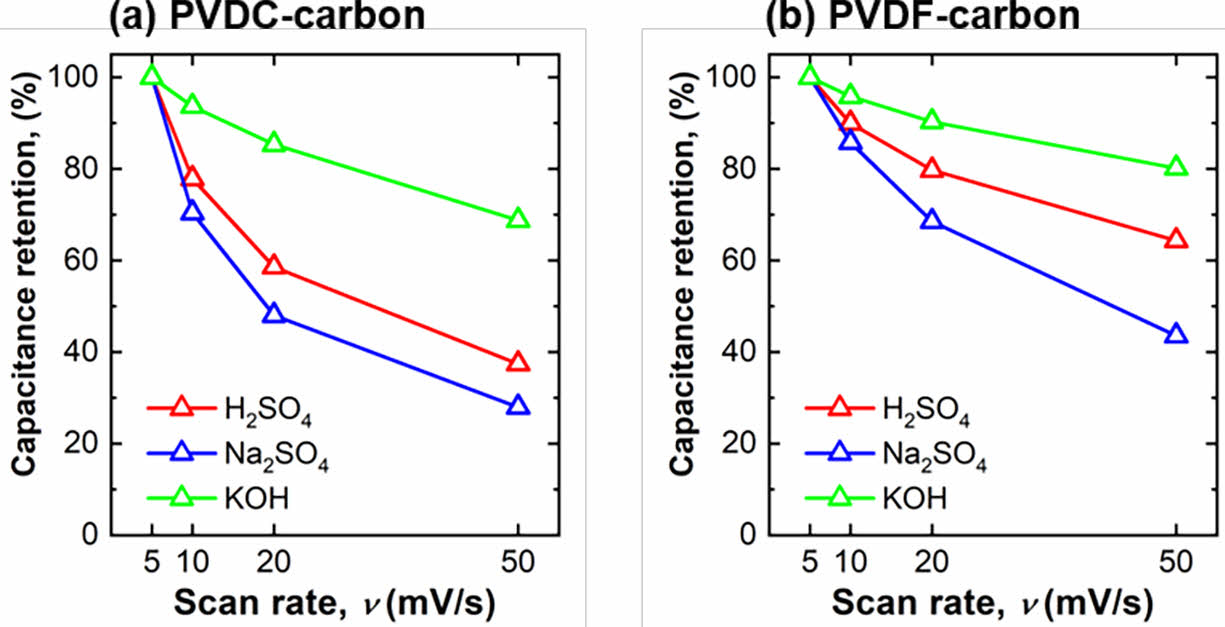
두 탄소 전극(PVDC-carbon, PVDF-carbon)에 대해 여러 pH의 전해질에서 율속 특성 즉, 고속에서 비전기용량의 유지율을 분석하였다(Fig. 4). 율속 특성 분석을 위해 5 mV s-1의 주사속도에서 측정한 비 전기용량 대비 10 빠른 주사속도(50 mV s-1)에서 용량의 보존율을 퍼센트로 계산하였다. PVDC-carbon 샘플과 PVDF-carbon 샘플은 KOH 전해질에서 각각 69%, 80%의 가장 높은 율속 특성을 보였다. KOH 용액에서의 높은 율속특성은 앞에서 언급한 것처럼 전해질을 구성하는 양이온(K+)의 높은 이온전도도와 음이온(OH-)의 선형적인 구조가 전해질 이온의 전극 표면으로 흡/탈착 반응을 용이하게 하였기 때문으로 생각된다. 또한 모든 전해질에서 PVDF-carbon 샘플이 PVDC-carbon 샘플의 율속 특성보다 높았다. PVDF-carbon 샘플의 높은 율속은 탄소 전극 표면에 존재하는 기공의 크기가 PVDC-carbon의 기공보다 상대적으로 더 컸기 때문으로 생각된다. 두 탄소 전극 모두 H2SO4 용액에서 Na2SO4 용액보다 높은 율속 특성을 보이는 이유는 두 전해질 모두 큰 크기의 음이온(SO42-)으로 구성되어 있음에도 불구하고 작은 크기의 H+ 이온 proton hopping 반응이 H2SO4 전해질에서 일어나 보다 용이하게 충/방전 반응이 일어났기 때문으로 생각된다.
|
Fig. 1 FE-SEM images of (a) carbon derived from PVDC-resin (PVDC-carbon) and (b) PVDF-derived carbon (PVDFcarbon). (c) N2 adsorption/desorption isotherms and (d) pore size distributions measured from the two synthesized carbons |
|
Fig. 2 X-ray photoelectron spectroscopic results measured on the two carbon samples: (a) survey scan and (b) O 1s and (c) N 1s high-resolution scan results of PVDC-carbon. (d) survey scan and (e) O 1s high-resolution scan results of PVDF-carbon |
|
Fig. 3 Cyclic voltammograms (scan rate: 5 mV s-1) of (a) PVDCcarbon and (b) PVDF-carbon samples in three different electrolytes (1 M H2SO4, 0.5 M Na2SO4, and 6 M KOH solution) |
|
Fig. 4 Capacity retention of (a) PVDC-carbon and (b) PVDFcarbon at various scan rates (5 mV s-1, 10 mV s-1, 20 mV s-1, and 50 mV s-1) measured in three different pH electrolytes (H2SO4, Na2SO4, and KOH) based on the specific capacitance measured at 5 mV s-1 |
|
Table 1 Various morphological properties of the two carbons synthesized from PVDC-resin and PVDF. a Specific surface area calculated by a multi-point BET method. b Total pore volume calculated from N2 adsorption at a relative pressure of (P/P0) = 0.95. c Total micropore volume calculated by QSDFT method |
|
Table 2 Composition analysis results of the two synthesized carbons (calculated from XPS survey scan) |
|
Table 3 Compositional ratio of functional groups presents in the two synthesized carbons (PVDC-carbon and PVDF-carbon) measured from XPS high-resolution scan |
|
Table 4 Specific capacitance measured in various pH electrolytes for two carbon electrodes |
탄소 주사슬에 이종원소들이 매달려 있는 구조의 PVDC-resin과 PVDF 두 폴리머 전구체는 열분해에 의해서 육각형 고리 구조의 탄소가 형성되며 동시에 이종원소들이 방출되며 마이크로 크기의 기공을 형성하여 다공성 탄소로 변환된다. 이러한 다공성 탄소는 높은 비표면적으로 이온의 흡/탈착에 유리하여 슈퍼커패시터용 탄소 전극으로 유리하다. 게다가 폴리머 전구체를 구성하는 여러가지 이종원소들은 탄화 후 작용기로 남아 전극으로 사용될 때 패러데익 반응으로 추가적인 전하 저장에 기여할 수 있다. PVDC-resin으로부터 유도된 탄소에서는 O와 N를 포함하는 작용기가 생성되었고, PVDF 전구체의 경우에는 O를 포함하는 표면 작용기가 형성되었다.
합성된 두 탄소 전극 모두 중성 전해질(0.5 M Na2SO4)에서 가장 낮은 비전기용량을 보였는데 이는 3차원 구조의 큰 크기의 음이온(SO4-)이 작은 크기의 기공 때문에 흡/탈착이 어려워졌기 때문이다. 또한, PVDC-carbon 전극의 비전기용량이 PVDF-carbon 전극보다 더 낮은 값을 가지는데, 그 이유는 PVDC-carbon에 생성된 매우 작은 마이크로 기공이 이온 흡착을 더욱 방해하였기 때문으로 생각된다. 산성전해질(1 M H2SO4)에서의 비전기용량은 중성 전해질에서 보다 증가하였으며 이는 탄소에 생성된 quinone 작용기의 산화/환원 반응이 전하 저장 반응에 기여하였기 때문이다. 염기성 전해질인 6 M KOH 용액에서 두 탄소 전극 모두 높은 비전기용량을 보였는데 이는 빠른 이온 전도도의 K+이온과 1차원 선형 구조인 OH-로 구성된 전해질내 이온들이 전극 표면으로 충방전이 쉽게 일어났기 때문이다[32]. KOH 전해질의 용이한 이온 흡/탈착으로 두 탄소 전극 모두 KOH 전해질에서 높은 율속 특성이 나타났다. H2SO4 전해질의 경우 작은 크기의 H+ 이온의 전극으로 흡/탈착이 용이하기 때문에, Na2SO4 전해질에서 보다 높은 율속 특성을 보였다. 따라서, PVDC-resin과 PVDF 폴리머로부터 유도된 탄소를 슈퍼커패시터 용 전극으로 사용하기 위해서는, 전해질의 pH에 따른 전극의 전기화학거동을 바탕으로 적절한 전해질을 선택하여 활용되어야 한다.
This work was supported by the National Research Foundation of Korea (NRF) funded by the Korean government (Ministry of Science, ICT & Future Planning) (NRF-2021R1A4A2001658; NRF-2022R1A2C1009922).
- 1. E. Frackowiak, F. Béguin, Supercapacitors: Materials, Systems and Applications, Poznan: Wiley-VCH Verlag GmbH & Co, 2013.
- 2. B.E. Conway, “Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications,” Springer Science & Business Media, 2013.
- 3. A. Borenstein, O. Hanna, R. Attias, S. Luski, T. Brousse, and D. Aurbach, “Carbon-based Composite Materials for Supercapacitor Electrodes: A Review,” Journal of Materials Chemistry A, Vol. 5, 2017, pp. 12653-12672.
-

- 4. W. Zuo, R. Li, C. Zhou, Y. Li, J. Xia, and J. Liu, “Battery‐supercapacitor Hybrid Devices: Recent Progress and Future Prospects,” Advanced Science, Vol. 4, 2017, pp. 1600539.
-

- 5. Z.S. Iro, C. Subramani, and S. Dash, “A Brief Review on Electrode Materials for Supercapacitor,” International Journal of Electrochemical Science, Vol. 11, 2016, pp. 10628-10643.
-

- 6. R. Yan, M. Antonietti, and M. Oschatz, “Toward the Experimental Understanding of the Energy Storage Mechanism and Ion Dynamics in Ionic Liquid Based Supercapacitors,” Advanced Energy Materials, Vol. 8, 2018, pp. 1800026.
-

- 7. H. Marsh and F.R. Reinoso, “Activated Carbon,” Elsevier, 2006.
-

- 8. K. Kinoshita, Carbon: Electrochemical and Physicochemical Properties, Wiley, US, 1988.
-

- 9. E. Frackowiak, “Carbon Materials for Supercapacitor Application,” Physical Chemistry Chemical Physics, Vol. 9, 2007, pp. 1774-1785.
-

- 10. I.-S. Son, Y. Oh, S.-H. Yi, W.B. Im, and S.-E. Chun, “Facile Fabrication of Mesoporous Carbon from Mixed Polymer Precursor of PVDF and PTFE for High-power Supercapacitors,” Carbon, Vol. 159, 2020, pp. 283-291.
-

- 11. B. Hwang and S.-E. Chun, “Fabrication of Mesoporous Carbon from Polyvinylidene Chloride (PVDC)-resin Precursor with Mg (OH) 2 Template for Supercapacitor Electrode,” Journal of the Korean Institute of Surface Engineering, Vol. 52, 2019, pp. 326-333.
-

- 12. I.-S. Son, S.-H. Yi, and S.-E. Chun, “Synthesis of Hydrophilic Hierarchical Carbon via Autonomous SiO2 Etching by Fluorinated Polymers for Aqueous Supercapacitor,” International Journal of Energy Research, Vol. 45, 2021, pp. 13836-13850.
-

- 13. B. Hwang, S.-H. Yi, and S.-E. Chun, “Dual-role of ZnO as a Templating and Activating Agent to Derive Porous Carbon from Polyvinylidene Chloride (PVDC) Resin,” Chemical Engineering Journal, Vol. 422, 2021, pp. 130047.
-

- 14. Y. Yang, A. Centrone, L. Chen, F. Simeon, T.A. Hatton, and G.C. Rutledge, “Highly Porous Electrospun Polyvinylidene Fluoride (PVDF)-based Carbon Fiber,” Carbon, Vol. 49, 2011, pp. 3395-3403.
-

- 15. K.-S. Kim and S.-J. Park, “Synthesis of Nitrogen Doped Microporous Carbons Prepared by Activation-free Method and Their High Electrochemical Performance,” Electrochimica Acta, Vol. 56, 2011, pp. 10130-10136.
-

- 16. C. Wang, B. Yan, J. Zheng, L. Feng, Z. Chen, Q. Zhang, T. Liao, J. Chen, S. Jiang, and C. Du, “Recent Progress in Template-assisted Synthesis of Porous Carbons for Supercapacitors,” Advanced Powder Materials, Vol. 1, 2021, pp. 100018.
-

- 17. A. Hossain, P. Bandyopadhyay, P.S. Guin, and S. Roy, “Recent Developed Different Structural Nanomaterials and Their Performance for Supercapacitor Application,” Applied Materials Today, Vol. 9, 2017, pp. 300-313.
-

- 18. C.A. Toles, W.E. Marshall, and M.M. Johns, “Surface Functional Groups on Acid-activated Nutshell Carbons,” Carbon, Vol. 37, 1999, pp. 1207-1214.
-

- 19. Y.J. Oh, J.J. Yoo, Y.I. Kim, J.K. Yoon, H.N. Yoon, J.-H. Kim, and S.B. Park, “Oxygen Functional Groups and Electrochemical Capacitive Behavior of Incompletely Reduced Graphene Oxides as a Thin-film Electrode of Supercapacitor,” Electrochimica Acta, Vol. 116, 2014, pp. 118-128.
-

- 20. B. Han, G. Cheng, Y. Wang, and X. Wang, “Structure and Functionality Design of Novel Carbon and Faradaic Electrode Materials for High-performance Capacitive Deionization,” Chemical Engineering Journal, Vol. 360, 2019, pp. 364-384.
-

- 21. Y. Zhao, A. Wang, L. Shen, L. Xiao, and L. Hou, “Carbohydrate Assisted Preparation of N-doped Hierarchically Porous Carbons from Melamine Resin via High Internal Phase Emulsion Template,” Microporous and Mesoporous Materials, Vol. 341, 2022, pp. 112039.
-

- 22. R. Jansen and H. Van Bekkum, “XPS of Nitrogen-containing Functional Groups on Activated Carbon,” Carbon, Vol. 33, 1995, pp. 1021-1027.
-

- 23. B. Xu, S. Hou, M. Chu, G. Cao, and Y. Yang, “An Activation-free Method for Preparing Microporous Carbon by the Pyrolysis of Poly(vinylidene fluoride),” Carbon, Vol. 48, 2010, pp. 2812-2814.
-

- 24. B. Xu, F. Wu, S. Chen, G. Cao, and Z. Zhou, “A Simple Method for Preparing Porous Carbon by PVDC Pyrolysis,” Colloids and Surfaces A: Physicochemical and Engineering Aspects, Vol. 316, 2008, pp. 85-88.
-

- 25. X. Chen, J. Zhang, B. Zhang, S. Dong, X. Guo, X. Mu, and B. Fei, “A Novel Hierarchical Porous Nitrogen-doped Carbon Derived from Bamboo Shoot for High Performance Supercapacitor,” Scientific Reports, Vol. 7, 2017, pp. 1-11.
-

- 26. Y.-H. Lee, K.-H. Chang, and C.-C. Hu, “Differentiate the Pseudocapacitance and Double-layer Capacitance Contributions for Nitrogen-doped Reduced Graphene Oxide in Acidic and Alkaline Electrolytes,” Journal of Power Sources, Vol. 227, 2013, pp. 300-308.
-

- 27. E. Calvo, N. Rey-Raap, A. Arenillas, and J. Menéndez, “The Effect of the Carbon Surface Chemistry and Electrolyte pH on the Energy Storage of Supercapacitors,” RSC Advances, Vol. 4, 2014, pp. 32398-32404.
-

- 28. G. Ferrero, A. Fuertes, and M. Sevilla, “From Soybean Residue to Advanced Supercapacitors,” Scientific Reports, Vol. 5, 2015, pp. 1-13.
-

- 29. M.T. Huynh, C.W. Anson, A.C. Cavell, S.S. Stahl, and S. Hammes-Schiffer, “Quinone 1 e– and 2 e–/2 H+ Reduction Potentials: Identification and Analysis of Deviations from Systematic Scaling Relationships,” Journal of the American Chemical Society, Vol. 138, 2016, pp. 15903-15910.
-

- 30. L. Eliad, E. Pollak, N. Levy, G. Salitra, A. Soffer, and D. Aurbach, “Assessing Optimal Pore-to-ion Size Relations in the Design of Porous Poly(vinylidene chloride) Carbons for EDL Capacitors,” Applied Physics A, Vol.82, 2006, pp. 607-613.
-

- 31. Y. He, Y. Zhang, X. Li, Z. Lv, X. Wang, Z. Liu, and X. Huang, “Capacitive Mechanism of Oxygen Functional Groups on Carbon Surface in Supercapacitors,” Electrochimica Acta, Vol. 282, 2018, pp. 618-625.
-

- 32. C. Zhong, Y. Deng, W. Hu, J. Qiao, L. Zhang, and J. Zhang, “A Review of Electrolyte Materials and Compositions for Electrochemical Supercapacitors,” Chemical Society Reviews, Vol. 44, 2015, pp. 7484-7539.
-

- 33. J.G. Speight, Lange’s Handbook of Chemistry, McGraw-Hill Education, 2017.
 This Article
This Article
-
2022; 35(6): 394-401
Published on Dec 31, 2022
- 10.7234/composres..2022.35.6.394
- Received on Oct 31, 2022
- Revised on Nov 28, 2022
- Accepted on Dec 11, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sang-Eun Chun
-
* School of Materials Science and Engineering, Kyungpook National University, Daegu 41566, Republic of Korea
** Department of Hydrogen & Renewable Energy, Kyungpook National University, Daegu 41566, Republic of Korea - E-mail: Sangeun@knu.ac.kr






 Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.
Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.