- Nonlinear Rheological Properties of Endothelial Cell Laden-cellulose Nanofibrils Hydrogels
Yeeun Song*, Min-Gyun Kim**, Hee-Gyeong Yi**,***, Doojin Lee*†
* Department of Polymer Science and Engineering, Chonnam National University, Gwangju, Korea
** Department of Rural and Biosystems Engineering, College of Agriculture and Life Sciences, Chonnam National University, Gwangju, Korea
*** Department of Convergence Biosystems Engineering, College of Agriculture and Life Sciences, Chonnam National University, Gwangju, Korea- 내피세포가 배양된 나노셀룰로오스 하이드로겔의 비선형 유변물성 분석
송예은* · 김민균** · 이희경**,*** · 이두진*†
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cellulose nanofibrils (CNF) based on wood pulp fibers are gained much attention as part of biocompatible hydrogels for biomedical applications such as tissue engineering scaffolds, biomedicine, and drug carrier. However, CNF hydrogels have relatively poor mechanical properties, impeding their applications requiring high mechanical integrity. In this work, we prepare 2,2,6,6-tetramethylipiperidin-oxyl (TEMPO) oxidated cellulose nanofibrils hydrogels mediated with metal cations, which form the metal-carboxylate coordination bonds for enhanced mechanical strength and toughness. We conduct the large amplitude oscillatory shear (LAOS) test and Live/dead cell assay for obtaining nonlinear viscoelastic parameters and cell viability, respectively. In particular, the cell proliferation and viability change depending on the type of metal salt, which also affected the rheological properties of the hydrogels
목재 섬유 기반의 셀룰로오스 나노피브릴(cellulose nanofibrils, CNF)은 생체적합특성이 우수하여 조직 공학용 스캐폴드, 약물 운반체, 상처 치유용 겔 등의 생체 의료 분야에서 많은 관심을 받고 있다. 하지만, 셀룰로오스 나노피브릴은 상대적으로 약한 기계적 강도를 나타내기 때문에 높은 기계적 특성을 요구하는 응용 분야에 사용되기 어렵다는 한계를 가지고 있다. 따라서 본 연구에서는 셀룰로오스 나노피브릴의 기계적 강도를 향상시키기 위해 TEMPO (2,2,6,6-tetramethylpiperidin-oxyl) 산화 처리된 셀룰로오스 나노피브릴에 금속 양이온을 도입하여 금속-카르복실레이트 배위 결합을 가지는 하이드로겔을 제조하였다. 또한, 큰 진폭 진동 전단(large amplitude oscillatory shear) 측정과 Live/Dead 세포 시험을 통해 하이드로겔의 비선형 점탄성 거동과 세포 생존 능력을 분석하였다. 특히, 첨가된 금속염의 종류에 따라 세포의 증식 및 생존 능력이 변화하였고, 이는 하이드로겔들의 유변 물성 특성에도 영향을 미쳤다
Keywords: 셀룰로오스 나노피브릴(Cellulose nanofibrils), 금속-카르복실레이트 배위결합(Metal-carboxylate coordination bonds), 비선형 점탄성(Nonlinear viscoelasticity), 세포 생존 능력(Cell viability)
셀룰로오스(cellulose)는 지구상에서 가장 풍부한 천연 고분자로 환경 친화적인 제품을 무한 공급할 수 있는 자원이다[1]. 셀룰로오스는 부드럽고 젖음성이 뛰어난 하이드로겔의 일종으로 목재, 대나무, 등나무, 면화 및 대마에 널리 존재하며[2], 셀룰로오스의 종류로는 목재 기반 셀룰로오스 나노피브릴(CNF), 박테리아 나노셀룰로오스(BNC) 및 셀룰로오스 나노결정(CNC) 등이 있다[1]. 특히, 셀룰로오스 나노피브릴은 목재들을 잘게 쪼개는 과정인 치핑(chipping), 펄프화(pulping), 그리고 나노 섬유화(nano-fibrillation)를 통해 투명한 겔(gel) 형태로 얻을 수 있다(Fig. 1). 셀룰로오스 하이드로겔인 셀룰로오스 나노피브릴(Cellulose nanofibrils, CNF)은 우수한 기계적 및 열적 특성을 제공하며 생체 적합성(biocompatibility) 등의 다양한 특성을 가지는 물질이다[3,4]. 또한, 셀룰로오스 나노피브릴은 생분해가 가능한 친환경적인 천연 고분자 물질로서, 이를 활용하기 위해 여러 분야에서 연구가 진행되고 있다[5].
셀룰로오스 나노피브릴의 표면에는 많은 수산기(-OH)가 존재하기 때문에 표면의 이온성을 조절할 수 있는 화학적 처리 방법 중 하나인 2,2,6,6-tetramethylipiperidin-oxyl (TEMPO) 촉매를 이용하여 TEMPO 촉매 산화 반응을 실시할 수 있다[5]. 이는 셀룰로오스의 6번 탄소의 수산기(-OH)를 카르복실기(-COOH)로 치환하여 셀룰로오스의 음이온성을 더욱 향상시킨다. 셀룰로오스 나노피브릴은 상처 치유용 겔(gel), 약물 운반체 및 조직 공학용 스캐폴드(scaffold)으로 광범위하게 연구되었고, TEMPO 산화를 통해 카르복실화된 TEMPO-CNF는 세포 생존(cell viability), 증식(proliferation), 이동(migration), 생체 적합성(biocompatibility) 및 세포 독성(cytotoxicity)에 대한 이점을 입증하는 생물 의학 응용에 관한 다양한 연구에 사용되고 있다[6]. 특히, 스캐폴딩 생체 재료 중에서 하이드로겔은 조직(tissue)의 물리화학적 및 생물학적 특성을 모방할 수 있기 때문에 3D 세포 배양에 유망한 물질이다[1].
최근에는 상대적으로 열악한 기계적 특성을 가지는 하이드로겔의 네트워크 구조를 최적화하는 연구가 진행되고 있으며, 고분자 하이드로겔인 셀룰로오스 나노피브릴을 이용한 연구가 활발히 진행되고 있다[3,4]. 셀룰로오스 나노피브릴의 기계적 물성을 향상시키기 위해 금속 배위 결합과 같은 희생 결합을 도입하여 고강도, 인성, 그리고 내피로성이 향상된 고성능 하이드로겔이 개발되고 있다[3,7]. TEMPO 산화와 같은 표면 개질을 통해 셀룰로오스 나노피브릴의 이온성을 조절할 경우 응집과 분산, 유변성 및 탈수성이 변화한다[5]. 또한, 금속 양이온의 원자가 수와 양이온의 정전기적 인력, 금속-카르복실레이트 결합에너지에 따라 하이드로겔의 구조적 회복 및 변형 거동이 변화한다[8]. 하이드로겔과 같은 고분자 물질 자체를 분석하기 위해서는 유변 물성이 유용하게 사용될 수 있다. 실제로 유변 물성 측정을 통해 하이드로겔의 이중 네트워크 형성 여부를 확인하거나[10], 셀룰로오스의 농도 혹은 가해지는 온도에 따른 겔화 특성을 분석[11]하는 등 다양한 연구가 진행되고 있다. 다양한 측정 방법 중 최근 활발히 연구되고 있는 큰 진폭 진동 유동인 LAOS(large amplitude oscillatory shear) 유동을 이용하여 비선형 점탄성 거동을 관찰할 수 있다[9]. LAOS 측정을 통해서 비선형성 매개변수들을 얻을 수 있고, 다양한 매개변수들을 이용하여 나노 입자들의 분산성과 내부 구조 특성 등을 분석할 수 있다[12]. 특히, 금속 배위 결합을 도입하기 위해 TEMPO-CNF의 카르복실기 (-COOH)와 금속 양이온을 물리적으로 가교하여 금속 양이온-카르복실레이트 배위 결합(metal cation-carboxylate coordination bonds)을 형성하고, 이러한 배위 결합은 구조적 회복 및 결합 강도를 향상시킨다[13,14]. 하지만, 희생 결합 형성에 의한 하이드로겔의 에너지 소산 메커니즘 혹은 가역적인 점탄성 반응에 대한 이해도는 아직 부족한 실정이며, 이에 대한 연구 결과 또한 부족하다.
본 연구에서는 셀룰로오스 나노피브릴의 기계적 물성인 강성과 인성을 향상시키기 위해 TEMPO-CNF와 금속염(metal salt)을 사용하여 금속-카르복실레이트 배위 결합을 형성하였다. 다양한 금속염을 사용하여 금속염의 양이온 가수(valency number)에 따른 에너지 소산 및 구조적 거동 변화를 유변 물성 측정을 통해 확인하였다. 또한, 내피세포를 배양하여 세포가 배양된 셀룰로오스 하이드로겔에서의 점탄성 변화를 관찰하였다. 금속 양이온을 가지는 셀룰로오스 나노피브릴이 생체적합성 특성을 유지하는지 확인하고자 TEMPO-CNF와 금속 배위 결합을 가진 M-TCNF 하이드로겔들에 세포 배양 후 형광 염색을 하여 세포의 사멸 및 생육을 판단하고자 하였다.
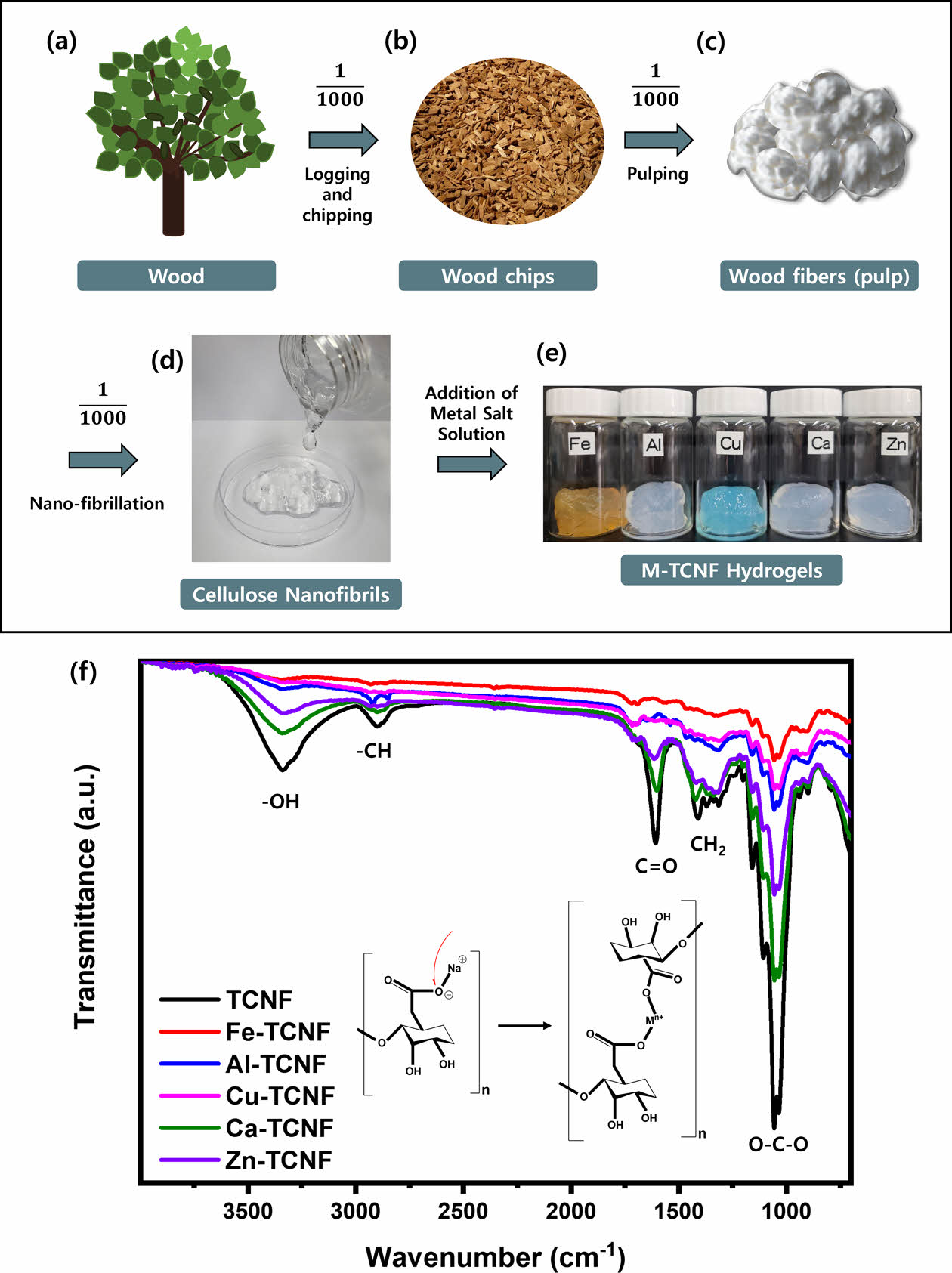
|
Fig. 1 (a-d) Manufacturing process of cellulose nanofibrils, (e) visual appearance of M-TCNFs, and (f) FT-IR results of TCNF and M-TCNF hydrogels |
2.1 재료 및 준비
본 연구에서는 TEMPO 촉매 산화 반응을 한 셀룰로오스 나노피브릴인 TCNF(tempo cellulose nanofibrils, 에이앤폴리㈜)와 Sigma Aldrich에서 구매한 5가지 금속염 (Fe(NO3)3, Al(NO3)3, Cu(NO3)2, Ca(NO3)2, Zn(NO3)2)을 사용하였다. 증류수에 각각의 금속염(metal salt)이 50 mM 농도가 되도록 용해시킨 후 2 wt% TCNF에 one-pot 방식으로 첨가하였다. 용해된 금속염 용액과 TCNF가 들어있는 샘플을 4oC 냉장고에 하루동안 보관하였다. 이후 반응하지 않고 남아있는 양이온들을 제거하기 위해서 금속-카르복실레이트 배위 결합을 형성한 하이드로겔들을 증류수로 세척하였다.
2.2 하이드로겔들의 유변학적 분석
순수한 TCNF와 금속-카르복실레이트 배위 결합된 하이드로겔(M-TNCF)들의 기계적 물성 및 변형 거동을 분석하기 위해 레오미터(rheometer) (MCR-302, Anton Paar, Austria)를 이용하여 유변학적 거동을 평가하였다. 유변물성 측정은 25 mm의 평판 플레이트(parallel plate)를 사용하였다. 다양한 유변물성 측정 방법 중 큰 진폭 진동 전단(large amplitude oscillatory shear, LAOS) 실험을 진행하였으며, LAOS 측정 시 각주파수(angular frequency)는 1 rad/s로 고정하여 변형율(strain)을 0.1-400%까지 증가시키면서 측정하였다. 모든 측정은 온도 제어 챔버(temperature-controlled chamber)를 이용하여 25oC로 유지하였고, 측정 중 TCNF와 M-TCNF 하이드로겔들의 수분 증발을 방지하기 위해 미네랄 오일로 외부 공기와 접촉을 차단하였다.
2.3 세포 배양(Cell Culture) 및 Live/Dead Cell Assay
본 연구에서는 혈관 내피세포(HUVEC)를 이용하여 순수한 TCNF와 M-TNCF 하이드로겔들의 세포 생존률을 확인하였다. HUVEC은 75 cm2 플라스크(flask)에 1 × 104 cells/cm2 만큼 세포 배양 배지(cell culture media)와 함께 넣어주어 계대배양 하였다. 37oC 인큐베이터(incubator)에서 세포를 배양하였고, XPBS로 세척한 후 트립신(trypsin) 처리를 통해 단백질 결합을 절단하였다. 트립신화는 단백질 분해 효소인 트립신을 사용하여 플라스크에서 부착된 세포를 분리하여 새 플라스크로 통과할 수 있도록 하는 과정이다. 이후, 트립신을 중화시키기 위해 TNS(5% FBS + XPBS)를 플라스크에 넣어 희석한 후 세포를 모아 원추형 튜브(conical tube)에 담아서 1000 rpm으로 3분 동안 원심 분리하여 검체를 채취하였다. 배지(media) 1 ml를 첨가한 후 TB(trypan blue) 용액과 1:1로 혼합한 후 세포 수를 계산하였고, live and dead cell assay를 위해 1 × 105 cells/ml 농도로 각각의 하이드로겔 표면에 천천히 넣은 후 1일, 3일, 7일 동안 5% CO2를 포함하는 가습 분위기의 37oC 배양기에서 배양하였다. 각각의 날짜가 되면 XPBS로 세척 후 파라포름알데히드로 세포를 고정하였고, 살아있는 세포(live cell)와 죽은 세포(dead cell)를 관찰하기 위해 세포 염색약을 넣어준 후 현광현미경으로 관찰한 후 세포 생존력 측정은 아래의 식으로 계산하였다.
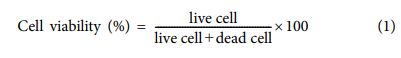
본 연구에서는 물리적 가교를 통하여 TCNF에 금속-카복실레이트 배위 결합을 형성하였다. TCNF는 금속염의 양이온과 배위 결합한 후 Fig. 1e와 같이 고체와 같이 형태를 가지며, FT-IR 측정을 통해 금속-카르복실레이트 배위 결합의 형성 여부를 확인하였다(Fig. 1f). 선행 연구된 결과와 유사하게 순수한 TCNF는 3340 cm-1 부근에서 -OH stretching, 2900 cm-1 부근에서 -CH, 1608 cm-1 부근에서 C=O asymmetric stretching, 1410 cm-1 부근에서 -CH2, 그리고 1050 cm-1 부근에서 -O-C-O- 피크를 나타낸다[15,16]. 모든 하이드로겔들이 나타내는 FT-IR의 특성 피크는 동일하지만, 금속 양이온의 가수와 배위 결합의 형성에 따라 1050 cm-1 부근의 -O-C-O- 피크의 감소를 통해 배위 결합이 형성되었음을 확인하였다. 특히, TCNF의 카르복실기와 더 많이 배위 결합을 할 수 있는 M-TCNF는 3가 양이온을 가지는 M-TCNF 하이드로겔이기 때문에 3가 양이온을 가지는 하이드로겔들이 2가 양이온을 가지는 하이드로겔들보다 피크 강도가 더 감소하는 경향을 나타낸다. 이는 금속 양이온의 가수가 M-TCNF의 특성에 영향을 미칠 수 있다는 것을 의미한다.
하이드로겔들이 세포 배양 전과 후에 기계적 물성 및 전단 변형율(shear strain)에 따른 무너짐 거동이 어떻게 달라지는지 확인하고자 하였다(Fig. 2). 세포를 배양하기 전에는 TCNF에 금속 양이온이 첨가될 경우 저장 탄성률(storage modulus, G')과 손실 탄성률(loss modulus, G'')이 순수한 TCNF 보다 10배 이상 증가하는 양상을 보이며, 2가 양이온을 가지는 M-TCNF 하이드로겔들 보다 3가 양이온을 가지는 하이드로겔들의 초기 G'이 더 큰 것을 볼 수 있다(Fig. 2A). 또한, 금속 양이온이 첨가될 경우 안정적인 선형 영역(linear region)이 낮은 변형율에서 나타나며, 3가 M-TCNF들이 2가 M-TCNF들 보다 긴 선형 영역을 가진다. 반면에, 세포를 배양한 후 측정한 TCNF와 M-TCNF 하이드로겔들의 경우 104 Pa 부근에서 유사한 초기 G' 값을 가진다(Fig. 2B). 특히, 2가 양이온을 가지는 M-TCNF 하이드로겔들은 금속염의 종류와 관계없이 거의 동일한 선형 영역과 무너짐 거동을 나타낸다(Fig. 2B-ii). 세포 배양 전과 후의 가장 큰 차이점은 초기 G' 값과 선형 영역의 길이이다. 순수한 TCNF의 경우 세포 배양 전이 세포 배양 후 보다 초기 G' 값이 작지만, M-TCNF들의 경우 세포 배양 전 보다 세포 배양 후의 초기 G' 값이 감소하는 경향을 보인다. 이는 세포 배양 7일 후 TCNF에서 세포가 더 잘 살아있고, 세포 자체가 고체 특성을 나타내어 탄성(elastic) 특성을 향상시키기 때문에 탄성률이 무너지지 않도록 하여 나타나는 현상이다. 따라서, TCNF의 경우 7일 후에도 세포가 잘 살아있지만, M-TCNF들의 경우 TCNF 보다 세포의 생존 능력(viability)이 낮기 때문에 세포 배양 전과 후의 초기 G' 값이 차이가 나는 것이다. 이는 LAOS 측정을 통해 얻을 수 있는 비선형 매개변수인 I3/1(=I3/I1), T(thickening) 및 S(stiffening) 인자들을 통해서도 확인할 수 있다.
푸리에 변환(Fourier transform)을 이용한 분석 방법은 비선형 응력곡선을 정량화하여 물질의 비선형 반응을 민감하게 해석하는 방법이며, 푸리에 변환을 통해 주파수의 함수로 값을 표현할 수 있다. LAOS 측정에서는 응력곡선을 푸리에 변환하여 비선형 정도를 정량화 할 수 있고, 이를 FT-유변학(FT-Rheology)라고 한다[9]. FT-유변학을 통해 비선형도(nonlinearity)를 나타내는 ‘I3/1’을 얻을 수 있으며, 하이드로겔의 내부구조에 따른 비선형 거동을 분석할 수 있다. 세포를 배양하기 전 하이드로겔들의 경우 순수한 TCNF와 M-TCNF 하이드로겔들의 거동이 다르게 나타나지만, 세포 배양 후에는 모든 하이드로겔들의 I3/1 거동이 거의 유사하게 나타난다. 세포 배양 전 하이드로겔들의 경우 순수한 TCNF는 변형율의 증가에 따라 I3/1이 증가하다 감소한 후, 다시 증가하는 거동을 보이며, 단단한 M-TCNF 하이드로겔들의 경우 변형율의 증가에 따라 I3/1은 증가하는 거동만 보여준다. 또한, 세포 배양 전 M-TCNF들의 경우 사용된 금속염의 종류에 따라 비선형성이 증가하는 변형율이 다르지만, 세포 배양 후에는 비선형성이 증가하는 변형율 지점이 거의 유사하게 나온 것을 확인할 수 있었다. 따라서, TCNF에 세포가 배양됨에 따라 금속 양이온과 TCNF가 미치는 영향보다 세포의 생존 능력에 따라서 미치는 탄성 특성이 더 지배적인 영향을 미친다는 것을 알 수 있다.
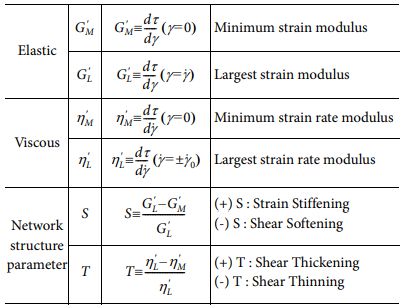
LAOS 측정을 통해 얻은 비선형 점탄성 매개변수들을 이용하여 응력(stress)과 변형(deformation)으로 곡선을 나타내는 Lissajous-Bowditch(LB) 곡선을 얻을 수 있다. LB 곡선을 통해 국부적 탄성 측정값(local elastic measures)과 국부적 점도 측정값(local viscosity measures)을 얻을 수 있고, 이를 이용하여 비선형 매개변수인 ‘strain-stiffening ratio (S)’와 ‘shear-thickening ratio (T)’를 얻을 수 있다. S와 T 매개변수를 얻기 위해 필요한 인자, 수식 및 경향성을 Table 1에 나타내었다.
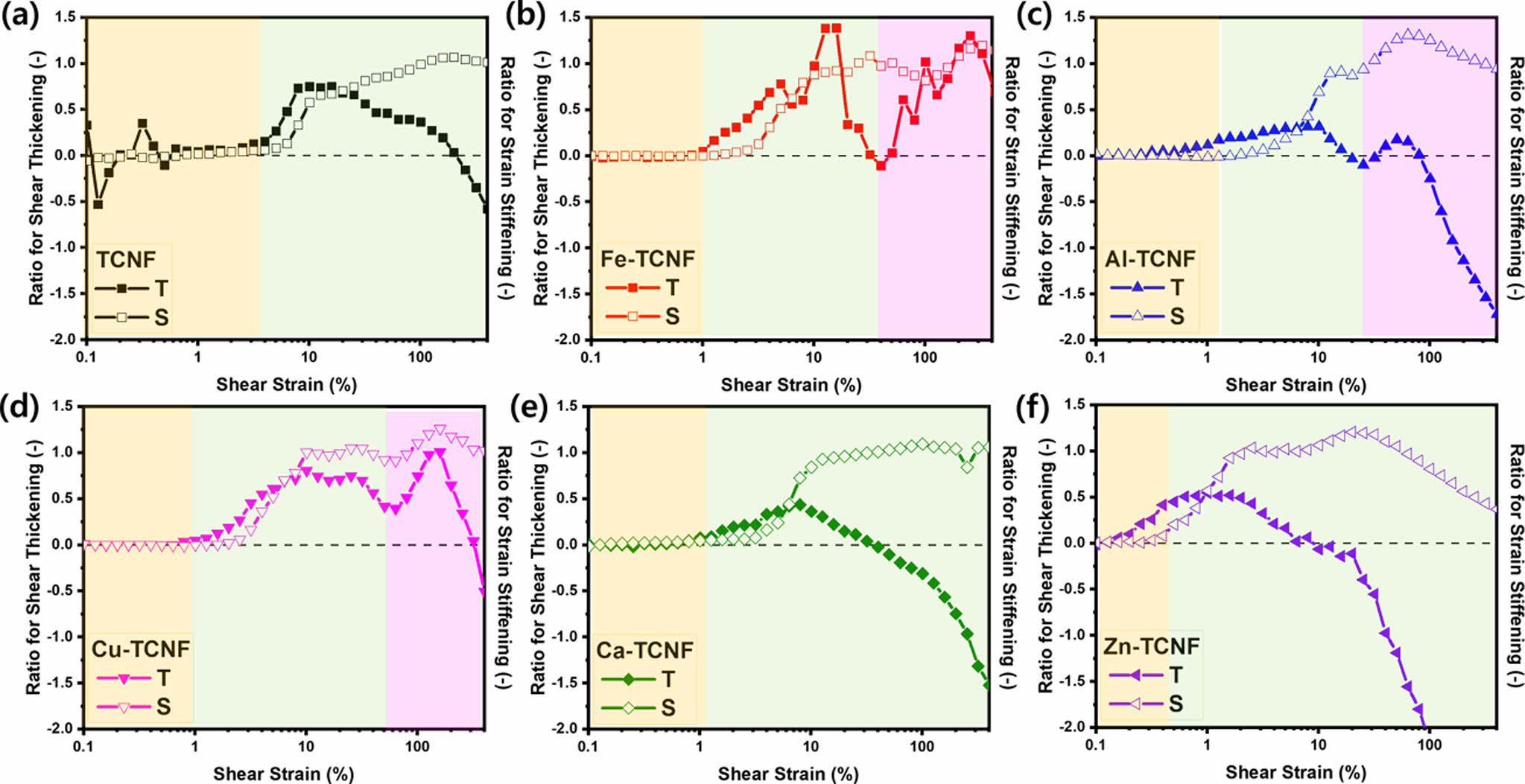
Fig. 4에서는 세포 배양 전 하이드로겔들의 S와 T 거동을 나타낸 것이고, Fig. 5에서는 세포 배양 후 하이드로겔들의 S와 T 거동을 나타낸 것이다. Fig. 2와 Fig. 3에서의 경향과 동일하게 세포 배양 전에는 금속염의 종류에 따라 거동이 다르지만, 세포 배양 후의 하이드로겔들의 거동은 모두 동일하다. 특히, 세포 배양 전 Fe-TCNF, Al-TCNF, 그리고 Cu-TCNF의 경우 T가 2번의 변곡점을 나타내지만, 세포 배양 후에는 모든 하이드로겔들이 단일 곡선과 유사한 S와 T 거동을 나타낸다. 이는 세포 배양 전 하이드로겔들이 더 복잡한 네트워크(network)를 가지고 있는 것을 의미하고, 금속염의 종류에 따라 금속-카르복실레이트 배위 결합이 구조적 무너짐 거동에 미치는 영향이 다르다는 것을 의미한다. 또한, 순수한 하이드로겔들의 경우 TCNF의 점성 거동이 우세하기 때문에 변형율이 증가할수록 전단 농화(shear thickening) 거동에서 전단 담화(shear thinning) 거동으로 변화하지만, 세포가 배양된 하이드로겔드르이 경우 세포의 탄성 특성이 더 우세하게 발현되어 T가 0보다 큰 전단 농화 거동만 나타내는 것을 확인할 수 있다.
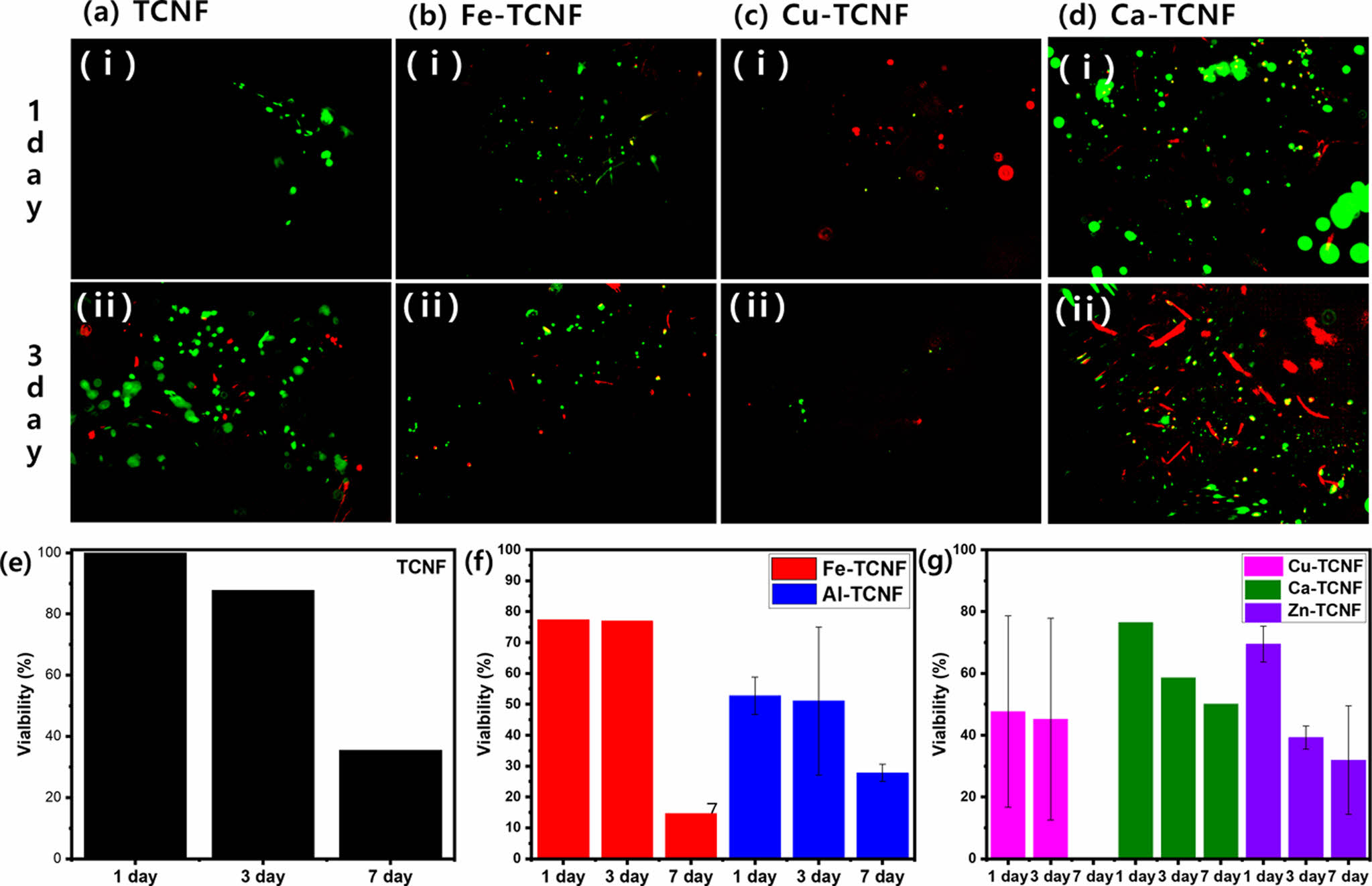
기계적 물성 및 유변학적 거동이 다른 하이드로겔들 위에 배양한 HUVEC 세포의 활성도를 Live/Dead 측정을 통해 분석하였다(Fig. 6). 녹색 형광을 띄는 세포는 살아있는 세포이고 붉은 형광을 띄는 세포는 죽은 세포이며(Fig. 6a-d), 셀룰로오스 나노피브릴도 식물 세포의 일종이기 때문에 세포 염색 용액에 염색이 되어 빨간 막대(rod) 형태로 나타나기도 하였다. 현광현미경으로 측정된 생존한 세포(live cell)와 죽은 세포(dead cell) 수를 측정하여 세포의 생존 능력(cell viability)을 수식 (1)과 같이 계산할 수 있었다. 많은 연구에서 알려진 바와 같이 순수한 TCNF의 경우 세포 증식 및 세포 생존 능력이 뛰어났다. M-TCNF 하이드로겔들의 경우 약간의 감소가 있지만 7일 후 Cu-TCNF에서의 생존 능력을 제외하고 모든 M-TCNF들 에서도 TCNF에 버금가는 세포 생존 능력을 나타냈다. 결과적으로 TCNF에 금속 양이온이 첨가되어도 독성을 나타내지 않기 때문에 세포를 배양할 수 있다는 것을 확인할 수 있었다. 이러한 세포의 생존 능력으로 인하여 세포가 배양된 하이드로겔의 경우 점탄성 특성이 달라짐을 확인할 수 있었으며, 이를 토대로 세포가 배양된 하이드로겔의 점탄성 특성이 기존의 하이드로겔과 상이하게 달라짐을 알 수 있었다.
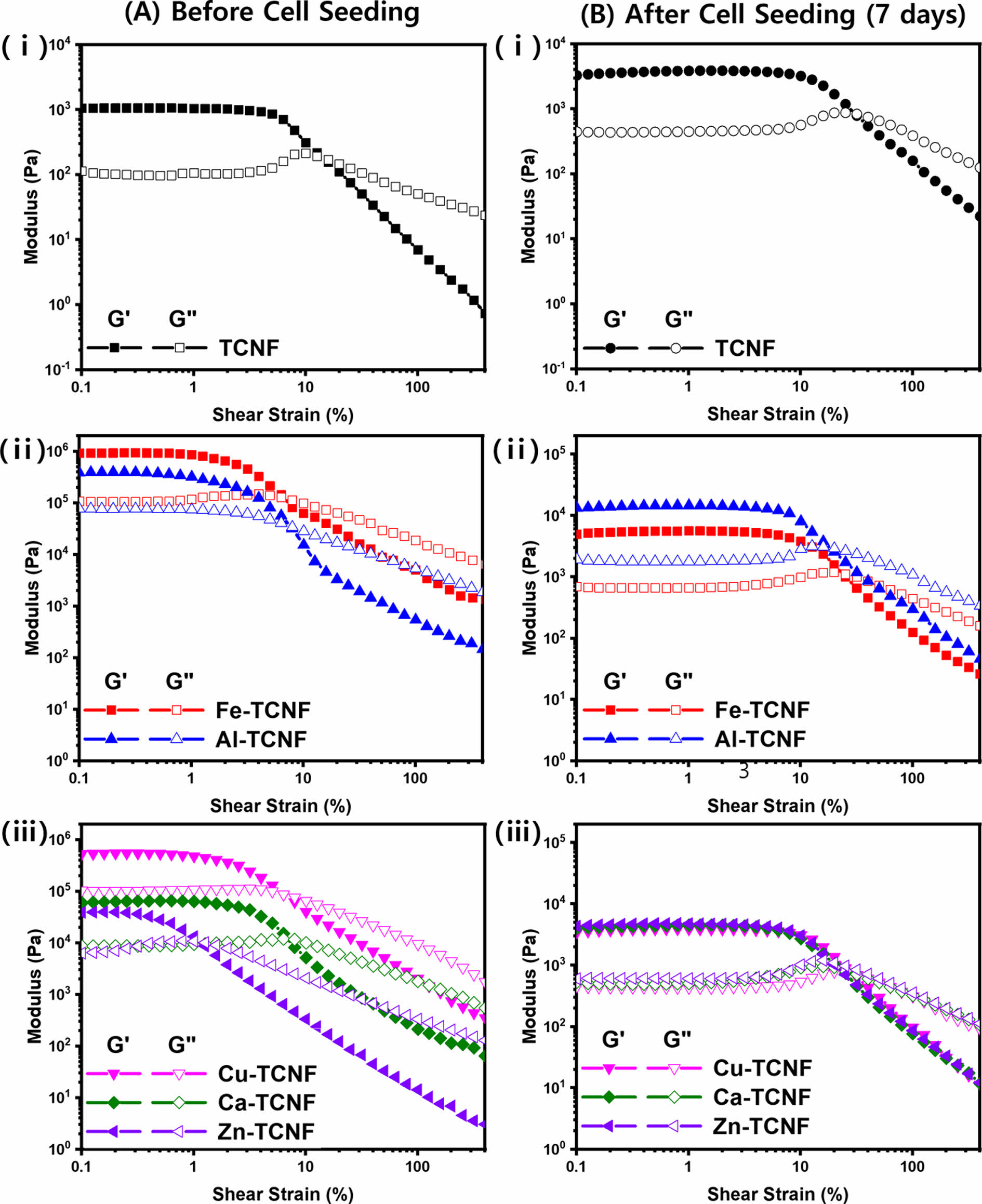
|
Fig. 2 Strain amplitude sweep test of TCNF and M-TCNF (A) before and (B) after cell proliferation (7 days): (i) neat TCNF, (ii) trivalent MTCNF hydrogels, and (iii) divalent M-TCNF hydrogels |
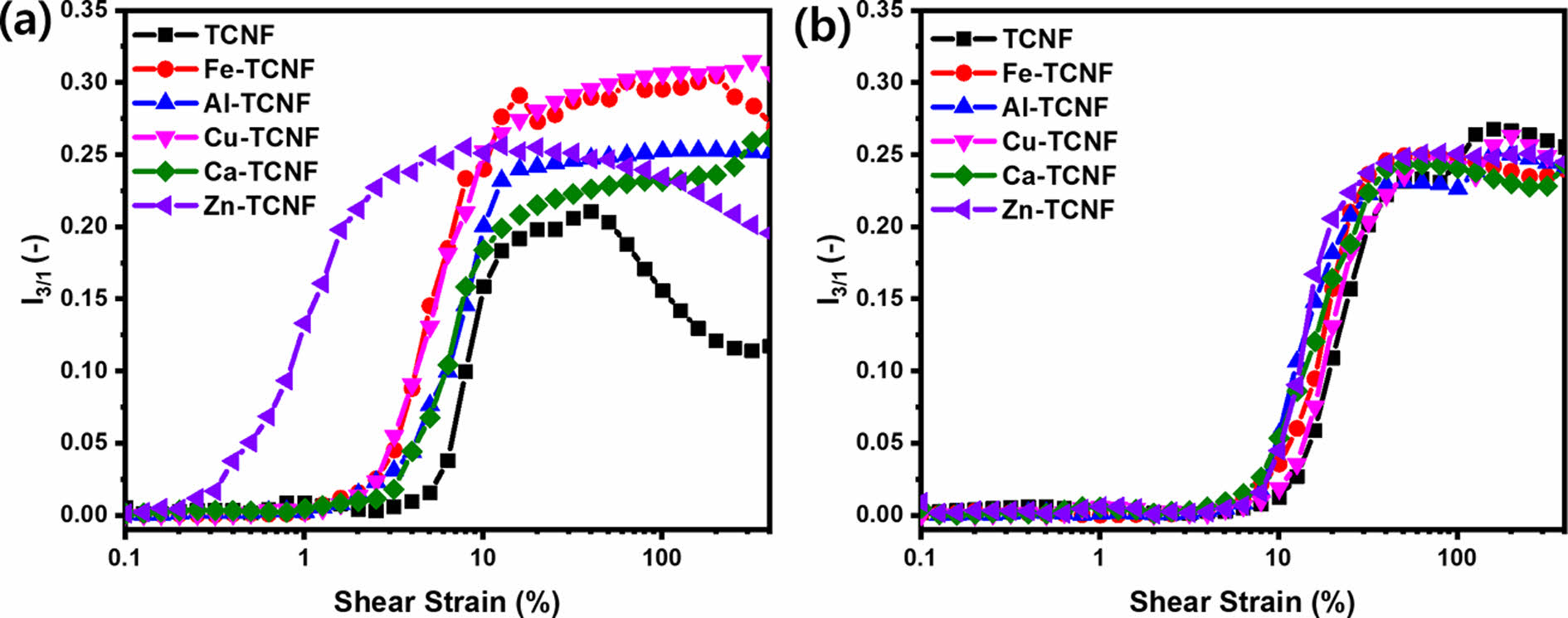
|
Fig. 3 Variation of the relative intensity of the third harmonic (I 3/1) as a function of strain amplitudes for TCNF and M-TCNF hydrogels (a) before cell and (b) after cell proliferation |
|
Fig. 4 Stiffening ratio S, and thickening ratio T as a function of strain amplitude for (a) TCNF, and M-TCNF with different metal salt cations of (b) Fe3+, (c) Al3+, (d) Cu2+, (e) Ca2+, and (f) Zn2+ before cell proliferation |

|
Fig. 5 Stiffening ratio S, and thickening ratio T as a function of strain amplitude for (a) TCNF, and M-TCNF with different metal salt cations of (b) Fe3+, (c) Al3+, (d) Cu2+, (e) Ca2+, and (f) Zn2+ after cell proliferation |
|
Fig. 6 (a-d) Live and dead assay images of HUVEC cells cultured on TCNF, Fe-TCNF, Cu-TCNF, and Ca-TCNF hydrogels after 1 day and 3 7 days cell culturing. (e-g) Cell viability of TCNF and M-TCNF with different metal cations |
|
Table 1 Elastic and viscous nonlinearity, and network structure parameters (S and T) in response to imposed LAOS deformation |
TEMPO 촉매 산화 반응한 TCNF의 카르복실기와 금속염 용액의 금속 양이온을 물리적으로 가교 시켜 금속-카르복실레이트 배위 결합을 형성하였다. 배위 결합 형성을 통해 TCNF의 기계적 강도 및 인성을 향상시킬 수 있었고, 이는 변형 진폭 스윕(strain amplitude sweep) 측정을 통해 확인하였다. 순수한 TCNF 하이드로겔 보다 금속 양이온과 배위 결합한 M-TCNF 하이드로겔들의 초기 G' 값이 더 큰 것을 확인함으로써 기계적 물성이 향상되었음을 알 수 있었으며, 금속 양이온 가수가 큰 3가 양이온을 가지는 M-TCNF 하이드로겔들이 더 우수한 탄성률을 보였다. 즉, 하이드로겔들의 기계적 특성 및 변형 특성은 금속 양이온의 가수에 영향을 받는다는 것을 알 수 있었다. 하지만, 하이드로겔에 세포를 배양할 경우 금속 양이온의 영향보다 세포의 영향이 더 우세해졌다. 금속 양이온이 첨가된 셀룰로오스 나노피브릴의 세포친화성을 확인하기 위해 HUVEC을 이용하여 세포 배양을 진행하였고, 모든 금속 양이온에서 세포가 생존하는 것을 확인하였다. 세포의 경우 탄성이 우세한 고체의 특성을 나타내기 때문에 하이드로겔들의 표면에 세포가 배양될 경우 외부에서 가해지는 변형에 의해 무너지려는 셀룰로오스 나노피브릴의 점성 특성을 보완하게 된다. 따라서, 세포가 배양될 경우 M-TCNF 하이드로겔들의 탄성률 및 비선형 거동과 구조적 변형을 나타내는 I3/1, S와 T 인자들이 유사한 거동을 보여주었다. 또한, Live/dead Cell Assay를 통해 세포의 생존 능력을 확인하였고, 금속염이 첨가된 M-TCNF 하이드로겔도 순수한 TCNF와 같이 세포친화적 특성을 가진다는 것을 알 수 있었다. 결과적으로, TCNF에 금속 양이온을 첨가함으로써 TCNF의 기계적 물성을 향상시킬 수 있을 뿐만 아니라, TCNF의 세포친화성을 유지할 수 있다는 것을 확인하였다.
이 논문은 전남대학교 중견일반연구의 지원에 의한 연구임.
- 1. Rashad, A., Mustafa, K., Heggset, E.B., and Syverud, K., “Cytocompatibility of Wood-Derived Cellulose Nanofibril Hydrogels with Different Surface Chemistry,” Biomacromolecules, Vol. 18, No. 4, 2017, pp. 1238-1248.
-

- 2. Xing, L., Hu, C., Zhang, W., Guan, L., and Gu, J., “Biodegradable Cellulose I (II) Nanofibrils/poly(vinyl alcohol) Composite Films with High Mechanical Properties, Improved Thermal Stability and Excellent Transparency,” International Journal of Biological Macromolecules, Vol. 164, 2020, pp. 1766-1775.
-

- 3. Yang, J., Xu, F., and Han, C.R., “Metal Ion Mediated Cellulose Nanofibrils Transient Network in Covalently Cross-linked Hydrogels: Mechanistic Insight into Morphology and Dynamics,” Biomacromolecules, Vol. 18, No. 3, 2017, pp. 1019-1028.
-

- 4. Dong, H., Snyder, J.F., Williams, K.S., and Andzelm, J.W., “Cation-induced Hydrogels of Cellulose Nanofibrils with Tunable Moduli,” Biomacromolecules, Vol. 14, No. 9, 2013, pp. 3338-3345.
-

- 5. Sim, K., Youn, H.J., and Jo, Y., “Surface Modification of Cellulose Nanofibrils by Carboxymethylation and TEMPO-mediated Oxidation,” Palpu Chongi Gisul/Journal of Korea Technical Association of the Pulp and Paper Industry, Vol. 47, No. 2, 2015, pp. 42-52.
-

- 6. Rosendahl, J., Svanström, A., Berglin, M., Petronis, S., Bogestål, Y., Stenlund, P., Standoft, S., Ståhlberg, A., Landberg, G., Chinga-Carrasco, G., and Håkansson, J., “3D Printed Nanocellulose Scaffolds as a Cancer Cell Culture Model System,” Bioengineering, Vol. 8, No. 7, 2021, pp. 1-14.
-

- 7. Zhao, X., “Multi-scale Multi-mechanism Design of Tough Hydrogels: Building Dissipation into Stretchy Networks,” Soft Matter, Vol. 10, No. 5, 2014, pp. 672-687.
-

- 8. Ju, Y., Ha, J., Song, Y., and Lee, D., “Revealing the Enhanced Structural Recovery and Gelation Mechanisms of Cation-induced Cellulose Nanofibrils Composite Hydrogels,” Carbohydrate Polymers, Vol. 272, 2021, p. 118515.
-

- 9. Hyun, K., “Analysis and Application of Nonlinear Rheological Properties by Large Amplitude Oscillatory Shear (LAOS) Test,” Polymer Science and Technology, Vol. 24, No. 2, 2013, pp. 183-190.
- 10. Moud, A.A., Kamkar, M., Sanati-Nezhad, A., Hejazi, S.H., and Sundararaj, U., “Viscoelastic Properties of Poly (vinyl alcohol) Hydrogels with Cellulose Nanocrystals Fabricated Through Sodium Chloride Addition: Rheological Evidence of Double Network Formation,” Colloids and Surfaces A: Physicochemical and Engineering Aspects, Vol. 609, 2021, p. 125577.
-

- 11. McKee, J.R., Hietala, S., Seitsonen, J., Laine, J., Kontturi, E., and Ikkala, O., “Thermoresponsive Nanocellulose Hydrogels with Tunable Mechanical Properties,” ACS Macro Letters, Vol. 3, No. 3, 2014, pp. 266-270.
-

- 12. Hyun, K., Wilhelm, M., Klein, C.O., Cho, K.S., Nam, J.G., Ahn, K.H., Lee, S.J., Ewoldt, R.H., and McKinley, G.H., “A Review of Nonlinear Oscillatory Shear Tests: Analysis and Application of Large Amplitude Oscillatory Shear (LAOS),” Progress in Polymer Science, Vol. 36, No. 12, 2011, pp. 1697-1753.
-

- 13. Yang, J., and Xu, F., “Synergistic Reinforcing Mechanisms in Cellulose Nanofibrils Composite Hydrogels: Interfacial Dynamics, Energy Dissipation, and Damage Resistance,” Biomacromolecules, Vol. 18, No. 8, 2017, pp. 2623-2632.
-

- 14. Niu, J., Wang, J., Dai, X., Shao, Z., and Huang, X., “Dual Physically Crosslinked Healable Polyacrylamide/cellulose Nanofibers Nanocomposite Hydrogels with Excellent Mechanical Properties,” Carbohydrate Polymers, Vol. 193, 2018, pp. 73-81.
-

- 15. Geng, C., Zhao, Z., Xue, Z., Xu, P., and Xia, Y., “Preparation of Ion-exchanged TEMPO-oxidized Celluloses as Flame Retardant Products,” Molecules, Vol. 24, No. 10, 2019, pp. 1-10.
-

- 16. Zhu, C., Soldatov, A., and Mathew, A.P., “Advanced Microscopy and Spectroscopy Reveal the Adsorption and Clustering of Cu(II) onto TEMPO-oxidized Cellulose Nanofibers,” Nanoscale, Vol. 9, No. 22, 2017, pp. 7419-7428.
-

 This Article
This Article
-
2022; 35(3): 153-160
Published on Jun 30, 2022
- 10.7234/composres.2022.35.3.153
- Received on Jun 10, 2022
- Revised on Jun 14, 2022
- Accepted on Jun 20, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Doojin Lee
-
Department of Polymer Science and Engineering, Chonnam National University, Gwangju, Korea
- E-mail: dlee@chonnam.ac.kr






 Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.
Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.