- Preparation of PVA/Graphene Oxide/Fe3O4 Magnetic Microgels as an Effective Adsorbent for Dye Removal
Seongmoon Go*, Keunseong Kim*, Eunsol Wi*, Rae-Su Park***, Hong-Ryun Jung****,
Changhun Yun*,**†, Mincheol Chang*,**†* Department of Polymer Engineering, Graduate School, Chonnam National University, Gwangju 61186, Korea
** School of Polymer Science and Engineering, Chonnam National University, Gwangju 61186, Korea
*** Department of Chemical Engineering, Chosun University, Gwangju 61452, Korea
**** Industry-University Cooperation Foundation, Chonnam National University, Gwangju 61186, Korea- 폴리바이닐알코올/그래핀 옥사이드/산화철 자성 마이크로겔을 이용한 염료 제거
고성문* · 김근성* · 위은솔*· 박래수***· 정홍련****· 윤창훈*,**† · 장민철*,**†
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
In this study, polyvinyl alcohol (PVA)/graphene oxide (GO)/iron oxide (Fe3O4) magnetic microgels were prepared using a microfluidic approach and the dye adsorption capacity of the microgels was confirmed. The adsorption capacity (qe) of the gels was evaluated by varying the dye concentration, pH, and contact time with the microgels. The dyes used in this work were methylene blue (MB), crystal violet (CV), and malachite green (MG), and microgels showed the highest adsorption capacity (191.1 mg/g) in methylene blue. The microgels exhibited the highest adsorption capacity in the dye aqueous solution at pH 10 due to the presence of atomic nitrogen ions (N+) on the dye molecules. The adsorption isotherm studies revealed that the Langmuir isotherm is the best fit isotherm model for the dye adsorption on the microgels, indicative of monolayer adsorption. The kinetic analysis exhibited that the pseudo-second order model fits better than the pseudo-first order model, confirming that the adsorption process is chemisorption. In addition, the magnetic microgels showed good reusability and recovery efficiency. It was confirmed that the adsorption capacity of the gels maintains more than 70% of the initial capacity after 5 times of cycle experiments
본 연구에서는, 미세유체 시스템 기반 폴리바이닐알코올(PVA)/그래핀 옥사이드(GO)/산화철(Fe3O4) 자성 마이크로겔을 제조하고 겔의 염료 흡착성능을 평가하였다. 겔의 흡착성능(qe)은 염료의 농도, pH, 및 접촉시간을 변수로 하여 평가하였다. 사용된 염료는 메틸렌 블루(MB), 크리스탈 바이올렛(CV), 말라카이트 그린(MG)이며, 마이크로겔은 메틸렌 블루에 대해 가장 높은 흡착성능(191.1 mg/g)을 나타내었다. pH에 따른 겔의 흡착성능은 염료가 가지고 있는 atomic nitrogen 이온(N+)의 영향으로 모든 염료에서 pH가 10일 때 가장 높은 흡착성능을 나타냈다. 등온흡착 데이터분석을 통해 Langmuir 등온선의 일치도가 높아 단분자층 흡착임을 확인하였으며, 동역학적 분석에서는 유사 1차 반응 보다 유사 2차 반응의 일치도가 높아 화학흡착임을 확인하였다. 또한, 자성 마이크로겔의 회수와 겔표면에 흡착된 염료의 탈착을 통한 재사용 성능을 평가하였는데, 흡착성능은 흡∙탈착 5회동안 70% 이상의 성능을 유지하는 것으로 나타났다
Keywords: 미세유체(Microfluidics), 자성 마이크로겔(Magnetic Microgels), 삼투압(Osmotic Pressure), 염료제거(Dye Removal)
염색산업에서 발생하는 산업폐수는 유해한 염료성분을 포함하고 있어 방류시 환경오염을 발생시킨다. 특히, 유기 염료는 수역(水域)과 토양을 대규모로 오염시켜 생태계의 파괴를 초래하는데, 이는, 복잡한 방향족 구조를 가지고 있어 안정적이기 때문에 분해가 힘들고 처리하기 까다롭다[1]. 따라서, 효율적인 폐수처리방법이 필요하며 대표적인 방법으로 산화, 응집, 응고, 생분해, 액체 막 분리 및 광촉매 분해 등이 있다. 하지만, 상기 방법은 시간과 비용에 많은 투자가 필요하다[2]. 반면, 고체흡착제를 이용한 염료 제거는 높은 효율성, 낮은 비용, 취급의 용이성과 같은 장점이 있어 다양한 상황에서 염료를 제거하는 공정 중 하나로 채택되어지고 있다[3,4]. 현재까지 염색폐수의 처리를 위해 다양한 흡착제 연구가 진행되고 있으나 대부분 낮은 흡착용량과 높은 비용, 낮은 재사용 성능과 같은 문제점이 있다.
2차원 탄소나노물질인 그래핀 옥사이드(Graphene Oxide)는 그래핀의 산화된 형태이며 매우 큰 비표면적, 산소를 함유하는 풍부한 작용기(-OH, -COOH) 존재, 우수한 수(水) 분산성을 나타낸다. 이는 염료와 π–π 적층, 정전기적 인력과 같은 반응을 통해 염료 제거를 위한 우수한 흡착제로 주목받고 있다. 최근 그래핀 옥사이드를 이용한 염료 흡착에 대한 많은 선행 연구가 보고되고 있으며 다른 흡착제에 비해 우수한 흡착성능을 보여준다[5-7]. 그러나, 그래핀 옥사이드는 흡착 후 수용액상 염료로부터 분리가 어려워 실제적인 적용의 제한이 있으며, 수용액에 잔류하는 그래핀 옥사이드는 2차오염을 유발할 수 있다는 단점이 있다.
이러한 문제점을 해결하고자 본 연구에서는 회수 및 재사용이 가능한 폴리바이닐알코올(PVA)/그래핀 옥사이드(GO)/산화철(Fe3O4) 기반 자성 마이크로겔을 제조하고 겔을 이용한 염료 흡착 실험을 진행하였다. 마이크로겔을 제조하기 위해 미세유체 시스템을 이용하여 이중 유화액적(Water-in-Oil-in-Water, W/O/W)을 형성하였다. 이중 유화액적 코어 부분에는 마이크로겔의 주요성분인 PVA/GO/Fe3O4 복합재료가 도입되었고, 쉘 부분에는 실리콘오일이 도입되었다. 코어 부분에 존재하는 PVA/GO/Fe3O4 용액의 수소결합을 통한 겔화와 삼투압법을 이용한 오일 쉘의 파괴를 통해 자성 마이크로겔이 얻어졌다. 광학현미경(OM)과 푸리에 변환 적외선 분광학(FT-IR) 방법을 통해 제조된 마이크로겔의 구조를 분석하였다. 더 나아가, 다양한 실험 매개변수와 흡착 이론을 기반으로 하여 마이크로겔의 염료 흡착 거동에 대한 연구를 진행하였다.
2.1 재료
그래핀 옥사이드(Graphene Oxide, GO)는 Standard Graphene 사에서 구매하였고, PDMS(Polydimethylsiloxane)는 Dow Corning 사에서 구매하였다. 폴리바이닐알코올(MW = 13000-23000 g mol-1, 98% hydrolyzed), 산화철(Fe3O4, <50 nm particle size, nanopowder), 실리콘오일(50cST), 염화나트륨(NaCl), 염산(HCl)은 모두 Sigma-Aldrich 사에서 구매하였다. 염료로 사용된 메틸렌블루, 크리스탈 바이올렛, 말라카이트 그린 옥살레이트는 Alfa Aesar와 Sigma-Aldrich 사에서 구매하였다.
2.2 미세유체 장치
미세유체 장치는 유리사각관(OD 1.3 mm, ID 1 mm)의 중심에 점점 가늘어지는 형태인 2개의 원형 유리모세관 (OD 1 mm, ID 0.58 mm)을 넣고 축을 맞춰 조립한다. 원형 유리모세관 중 하나는 130 μm, 다른 하나는 270 μm로 갈아주고 둘사이의 거리는 270–280 μm로 고정한다. 유체는 시린지 펌프를 이용하여 주입하는데 이때, PTFE 튜브(OD 2 mm, ID 1 mm)를 장치에 연결하여 유체가 흐르는 통로를 만들어준다. 코어(가장 안쪽), 쉘(중간), 연속상(바깥)의 유속은 각각 400, 400, 5000 μL h-1로 설정하였으며 이는, 시린지 펌프를 통해 제어하였다. 만들어진 이중 유화액적은 2M의 NaCl에 담가 두어 코어의 수축과 동시에 강도를 향상시키고 오일 쉘의 파괴로 자성 마이크로겔이 만들어진다. 만들어진 겔은 증류수로 5회 세척하여 겔 표면에 잔류하는 이물질을 제거하였다.
2.3 분석
마이크로겔의 형태는 광학현미경(OM), 작용기는 푸리에 변환 적외선분광학(FT-IR)을 통해 확인하였다. 자외선-가시광선 분광법(UV-VIS)을 통하여 염료에 대한 겔의 흡착성능을 평가하였으며, 흡착에 대한 등온선과 동역학적 분석을 진행하였다.
2.4 흡착 및 탈착실험
마이크로겔의 염료 흡착은 염료의 농도(100-3000 mg L-1), 접촉시간(0-180 min), pH(2-10)와 같은 다양한 변수조건하에서 실험을 진행하였다. 염료용액은 증류수에 메틸렌 블루, 크리스탈 바이올렛, 말라카이트 그린 옥살레이트 파우더를 3000 mg L-1로 용해하여 제조하였다. 농도와 접촉시간에 따른 흡착성능평가 실험에 사용된 염료용액의 pH는 6으로 유지하였으며, 이는, 0.1M 농도의 HCl과 NaOH를 이용하여 조절하였다. 흡착성능 평가는 UV-VIS 측정을 통해 확인하였으며, 다음 식을 이용하여 계산하였다.

여기서, V(L)는 염료용액의 부피이며, m(g)은 마이크로겔의 양, C0과 Ce는 각각 염료 용액의 초기 농도와 평형 농도를 나타낸다.
탈착은 0.1M HCl에 겔을 담그고 3시간 후 증류수로 3회 세척 후 건조시켰다. 건조된 겔을 이용하여 상기와 같은 방법으로 흡착실험을 5회 반복하여 재사용 성능을 평가하였다.
3.1 자성 마이크로겔 제조
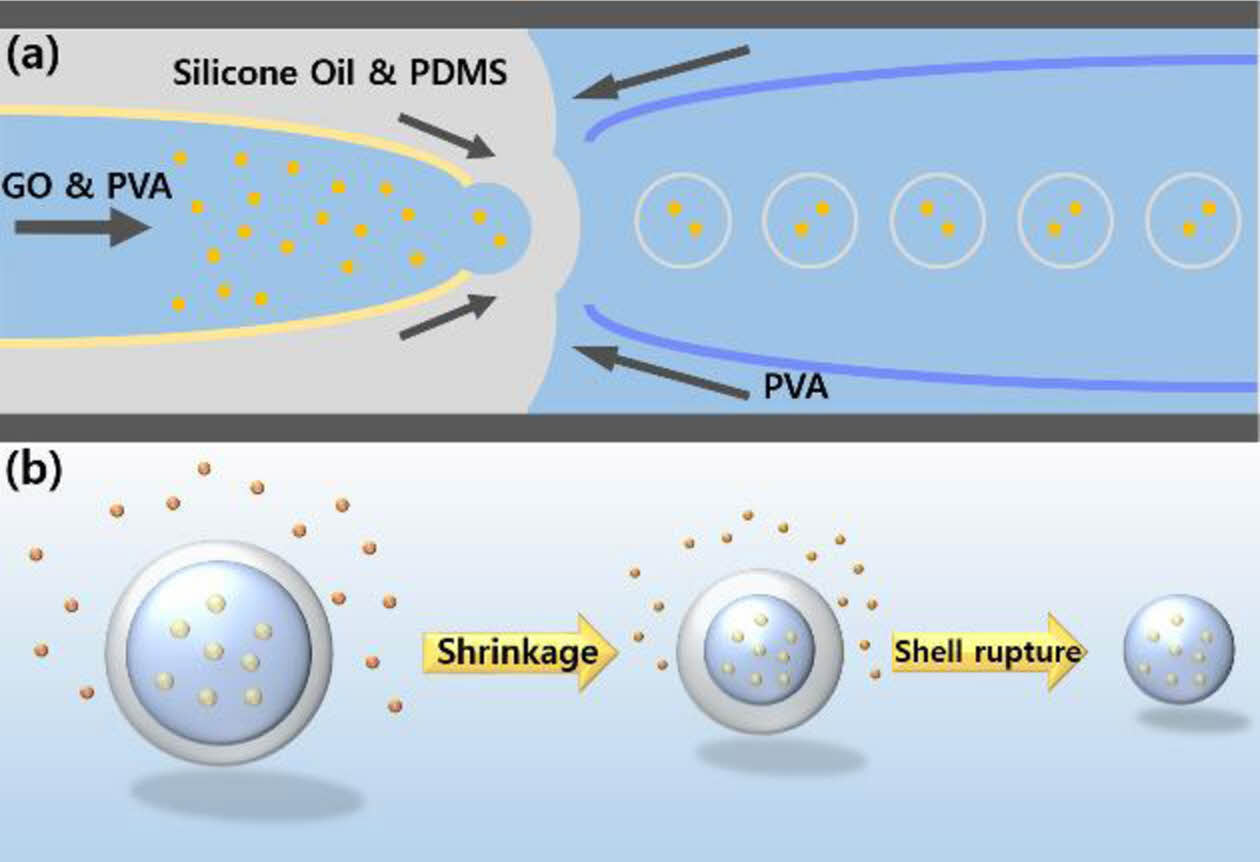
자성 마이크로겔의 제조방법은 Fig. 1을 통해 간략하게 나타내었다. Fig. 1a는 미세유체 시스템을 이용한 이중 유화액적의 제조 개략도를 나타내며, 가장 안쪽의 코어에 0.2 w/w%의 GO와 2 w/w% PVA, 20 mg의 산화철(Fe3O4)을 혼합한 용액을 주입하였다. 중간층의 오일상에는 실리콘오일과 PDMS를 7:3의 부피분율로 혼합하여 주입하였다. 가장 바깥의 연속상은 5 w/w%의 PVA를 주입하였다. 샘플은 2M NaCl 용액에 모아 코어와 연속상의 삼투압차를 이용하여 코어의 수축과 동시에 물이 빠져나가며 오일 쉘의 파괴를 통해 단일 마이크로겔이 만들어진다. 삼투압을 통한 겔의 제조과정은 Fig. 1b의 개략도를 통해 확인할 수 있다.
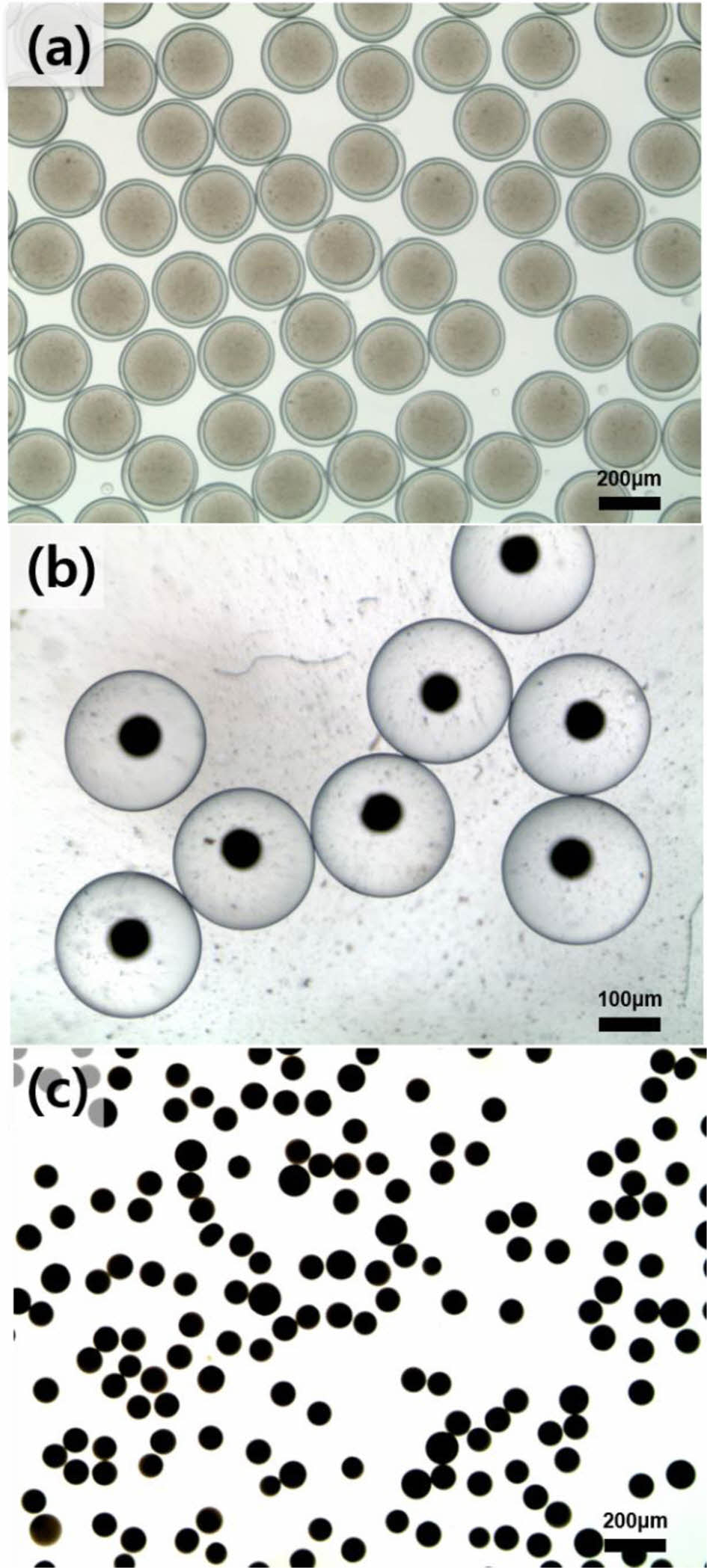
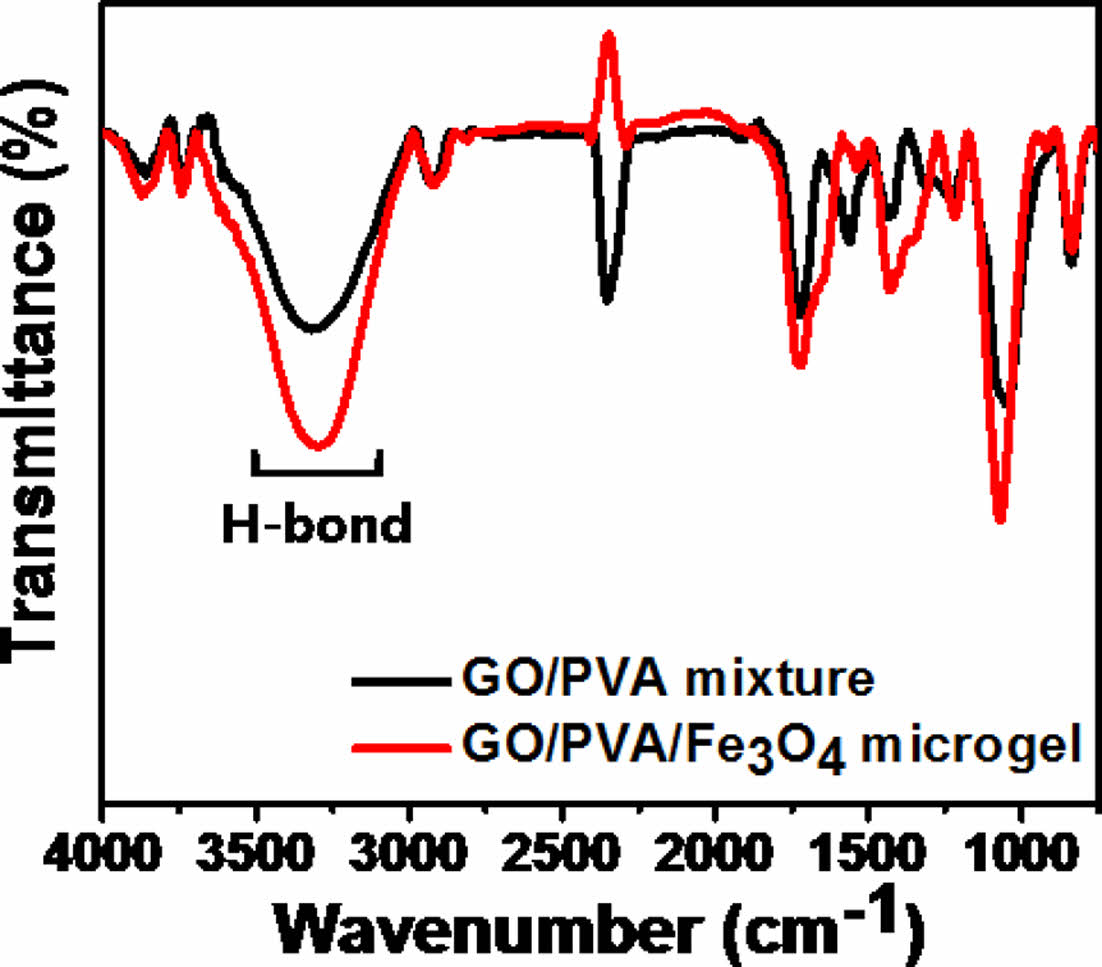
상기 과정은 광학현미경을 통해 관찰하였으며, 이는, Fig. 2에서 확인할 수 있다. GO는 하이드록시, 카르보닐, 카르복실, 에스테르기를 가지며 이는 PVA의 하이드록시기와 수소결합을 형성한다. 수소결합의 형성은 FT-IR 분석을 통해 확인하였으며 Fig. 3에 나타냈다. 파우더와 겔의 경우 모두 3400-3200 cm-1 사이에서 피크가 나타나는데 이는 수소결합을 나타낸다. 피크의 강도를 비교하면 GO, PVA 파우더 혼합물보다 마이크로겔의 피크가 더 크게 나타나는데, 이를 통해, PVA 분자간의 수소결합 외에 GO와 PVA 사이의 추가적인 수소결합이 형성되었음을 확인할 수 있다[8].
3.2 흡착실험
3.2.1 양이온염료 흡착
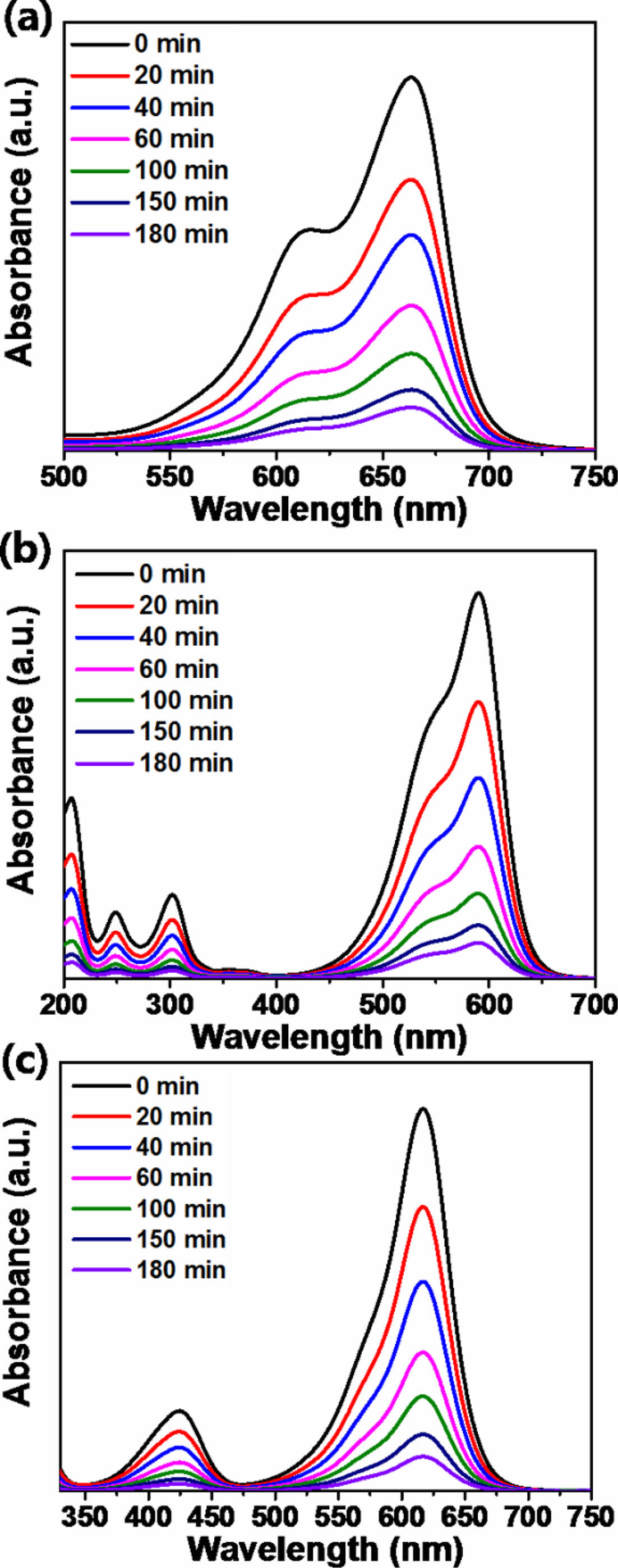
Fig. 4는 UV-VIS 측정을 통해 접촉시간에 따른 염료의 흡광도 변화를 나타낸다. 마이크로겔 0.05 g을 염료용액 5 ml에 넣어 흡착 실험을 진행하였으며 시간이 지남에 따라 염료용액의 흡광도가 낮아지며 흡광도 감소비율도 감소하는것을 확인할 수 있다. 이를 통해, 겔을 이용한 염료 흡착의 성공과 150분 이후 겔 표면의 염료 흡착 가능한 부위가 포화되었음을 확인할 수 있다.
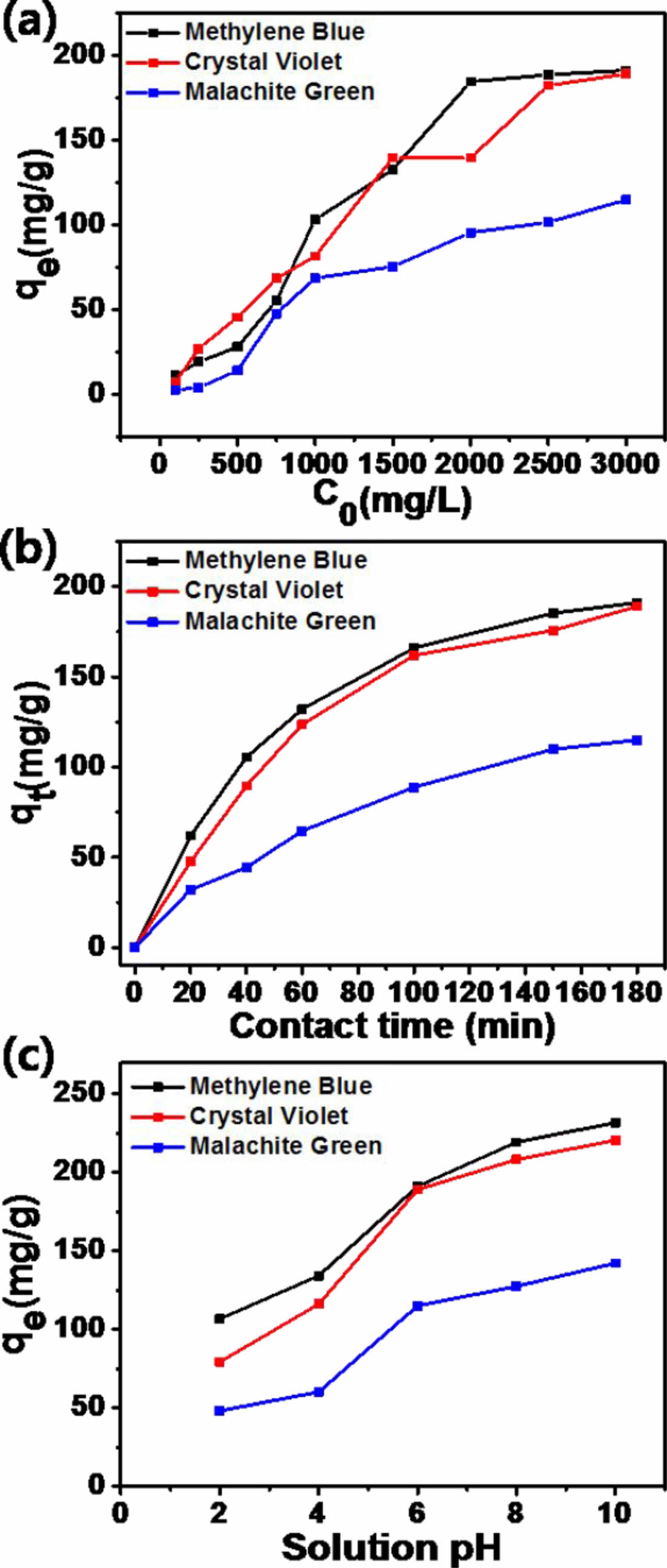
흡착 매개변수가 흡착성능에 미치는 영향을 이해하기 위해 초기 염료 용액 농도(C0), 접촉시간(t), pH와 같은 변수조건하에서 실험을 진행하였다. Fig. 5a는 MB, CV, MG의 초기 염료농도에 따른 흡착성능을 나타낸다. 흡착성능은 초기 농도가 100 mg L-1에서 3000 mg L-1로 증가함에 따라 9.3, 7.2, 2.9 mg/g에서 191.1, 189.0, 115.0 mg/g으로 증가하였다. 농도가 증가함에 따라 흡착성능의 증가는 낮은 농도에서는 흡착 후 마이크로겔 표면에 흡착 가능한 공간이 아직 남아있기 때문에 발생한다. 이러한 흡착공간은 농도가 증가함으로써 점차 사라지게 되며, 결국, 포화되어 2500 mg/L 이상의 농도에서는 성능이 유지되며, 겔 표면에 흡착 가능한 부위가 포화되었음을 확인할 수 있다. Fig. 5b는 시간에 따른 흡착성능을 나타내며 접촉시간이 증가함에 따라 흡착성능이 증가하다가 150분 이후에는 겔 표면의 흡착 가능한 공간이 포화되어 흡착성능이 증가하지 않는 것을 확인할 수 있다. 흡착 메커니즘의 이해를 위해 pH는 중요 매개변수 중 하나이다. 염료 용액의 pH가 낮으면 겔의 흡착성능이 감소하는 경향을 나타내는데, 이는, 겔 표면의 제한된 흡착 부위에 대한 염료분자와 양성자(H+)의 경쟁으로 인해 발생한다. 반면, 높은 pH에서는 음으로 대전된 겔 표면과 양이온성 염료 분자 사이의 정전기적 인력이 증가하여 우수한 흡착성능을 나타낸다. 이를 통해, 용액의 pH 변화가 염료의 이온화와 겔 표면의 흡착부위에 영향을 미치는 것을 확인할 수 있다[9-12].
3.2.2 흡착등온선 해석
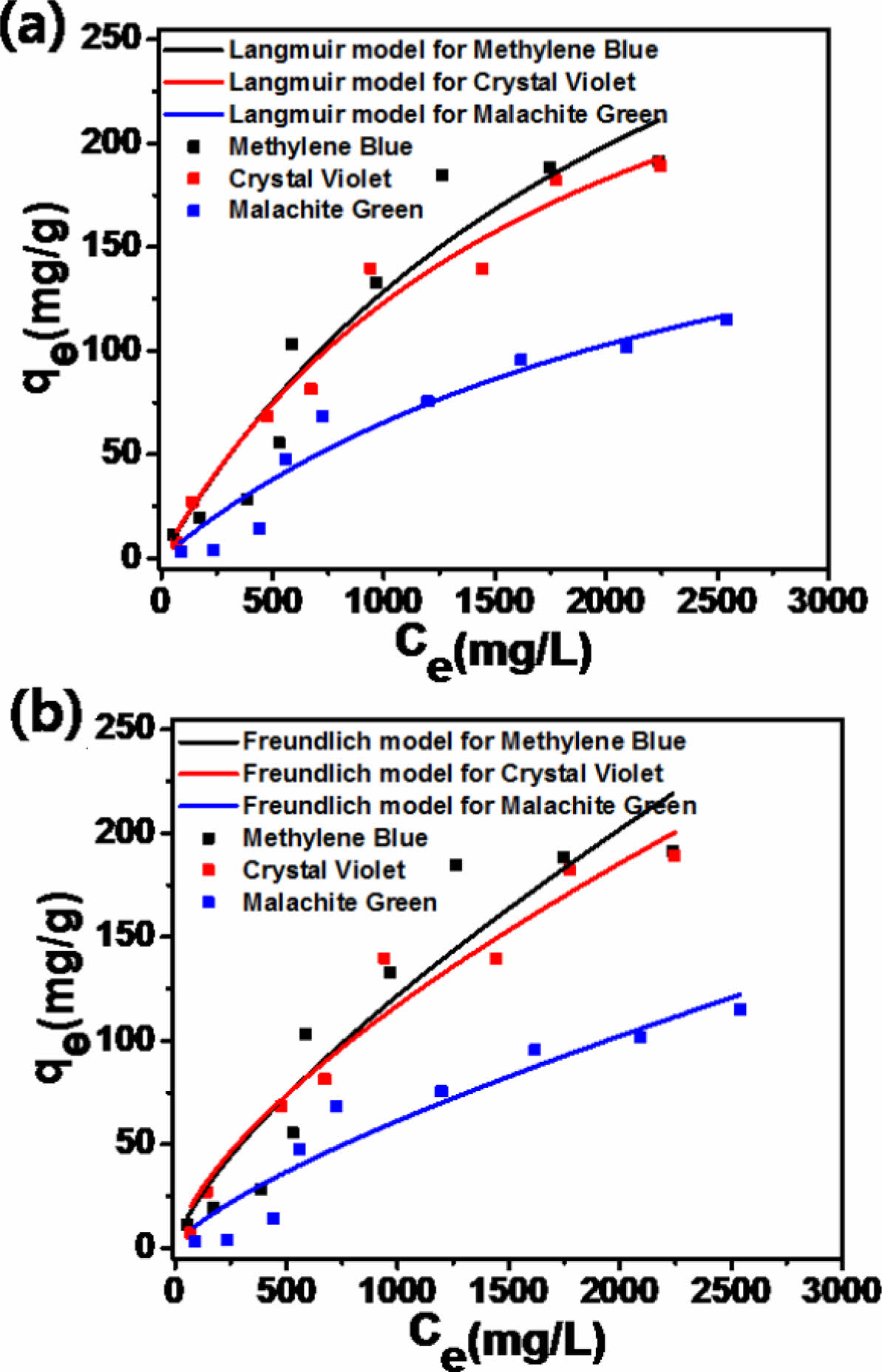
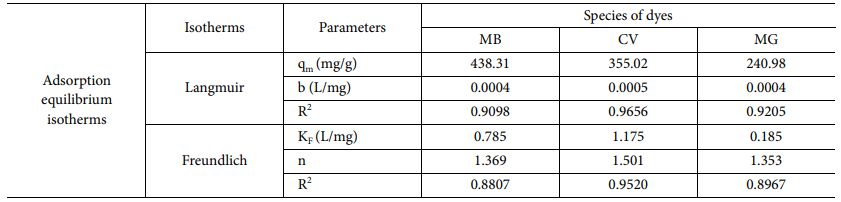
흡착등온선은 흡착제의 흡착거동과 메커니즘을 이해하기 위한 중요한 지표이다. 대표적으로 사용되는 Langmuir, Freundlich 등온식을 적용하였으며, 이는, 각각 Fig. 6a와 Fig. 6b에 나타냈다. Langmuir 모델은 흡착제 표면에 흡착물의 균일한 단분자층 흡착을 나타내며 Fruendlich 모델은 흡착제의 불균일한 표면에 대한 다중층 흡착에 대해 나타낸다. Langmuir와 Freundlich 흡착등온식은 다음과 같이 나타낸다.

여기서, qe(mg/g)는 평형상태에서의 흡착성능을 나타내며 Ce는 평형상태의 염료농도이다. b(L/mg)는 Langmuir 상수, nf와 Kf는 Freundlich 상수이다. qm(mg/g)은 마이크로겔의 최대 흡착 용량을 나타낸다.
Langmuir, Freundlich 등온선 모델의 계산된 매개변수는 Table 1에 나타냈다. 상관 계수(R2)는 세 종류의 염료 모두 Langmuir 모델에서 높게 나타났으며, 이는, 흡착제 표면의 균일한 단분자층 흡착에 더 적합하다는 결과를 나타낸다. 또한, 겔은 Langmuir 모델에서 MB, CV 및 MG에 대해 각각 476.71, 205.01 및 262.6 mg/g의 우수한 최대 흡착성능을 보여준다[13,14].
3.2.3 흡착동역학의 해석
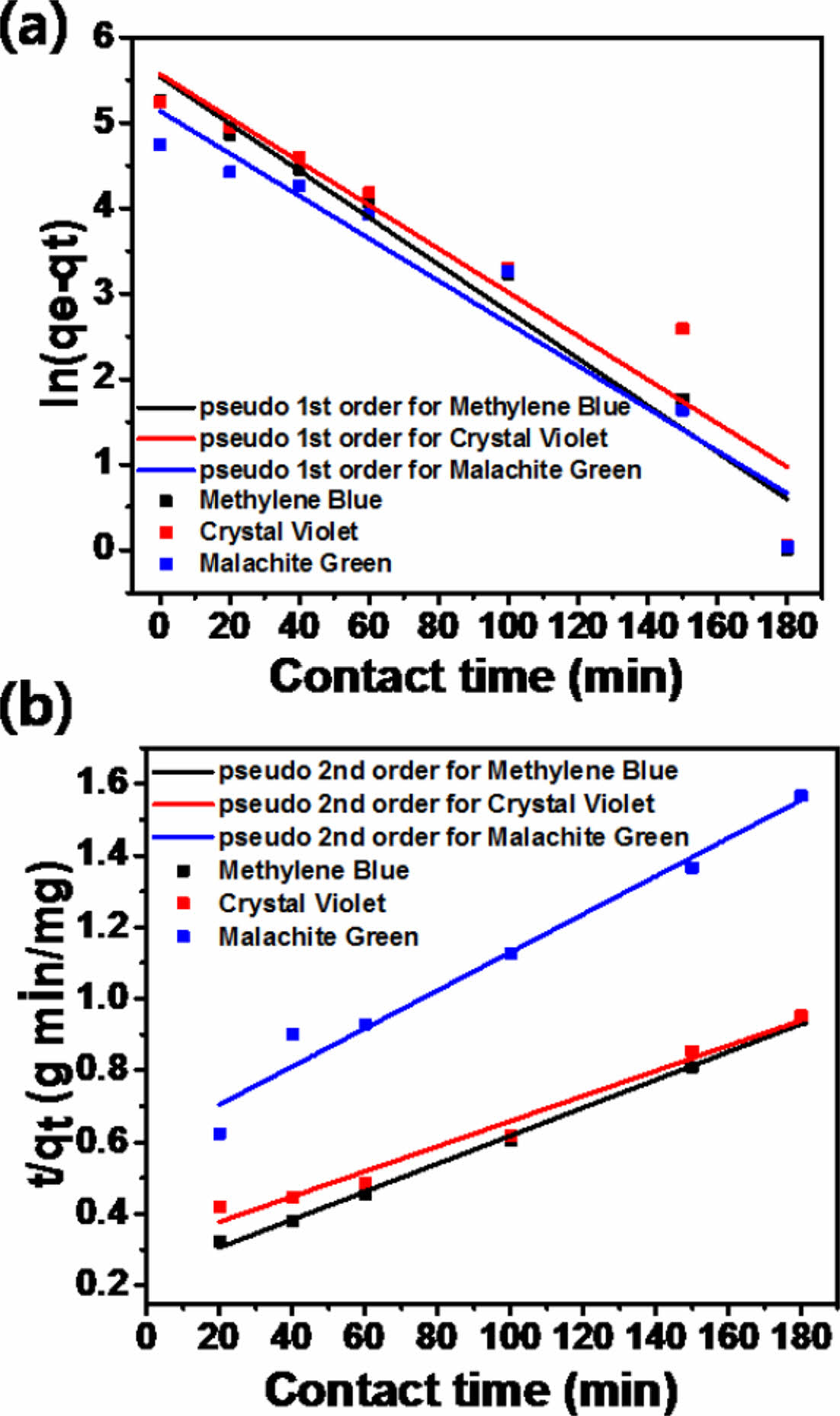
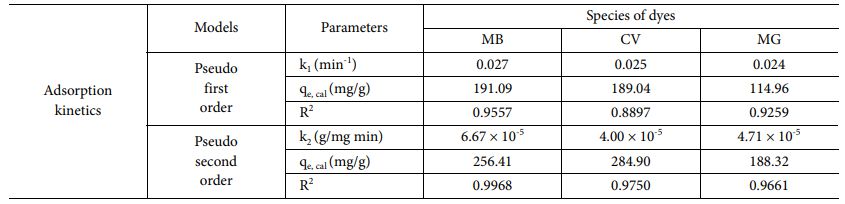
마이크로겔의 흡착과정에 대한 추가적인 이해를 위해 유사 1차 및 유사 2차 방정식에 적용했다. 방정식은 다음과 같이 나타낸다.

여기서, qe(mg/g), qt(mg/g)는 각각 평형상태 및 시간(t)에 따른 겔의 흡착성능이며 k1(min-1) 및 k2(g mg-1 min-1)는 각각 유사 1차 및 유사 2차 속도 상수이다. Fig. 7a, b와 Table 2는 시간에 따른 흡착량의 변화를 각각 유사 1차 및 유사 2차 식에 적용한 그래프와 매개변수표이다. 화학흡착은 흡착제와 흡착물 사이의 화학 반응을 포함하는 흡착이며 유사 2차 모델이 흡착제의 흡착 동역학이 화학 반응에 의해 제어됨을 설명하는 데 사용된다. 계산된 상관 계수(R2)에 따르면 유사 2차 모델이 더 적합하다는 것을 보여주므로 화학 흡착이 지배적이며, 이는, 겔의 흡착속도를 결정한다[15].
3.3 마이크로겔의 회수 및 재사용
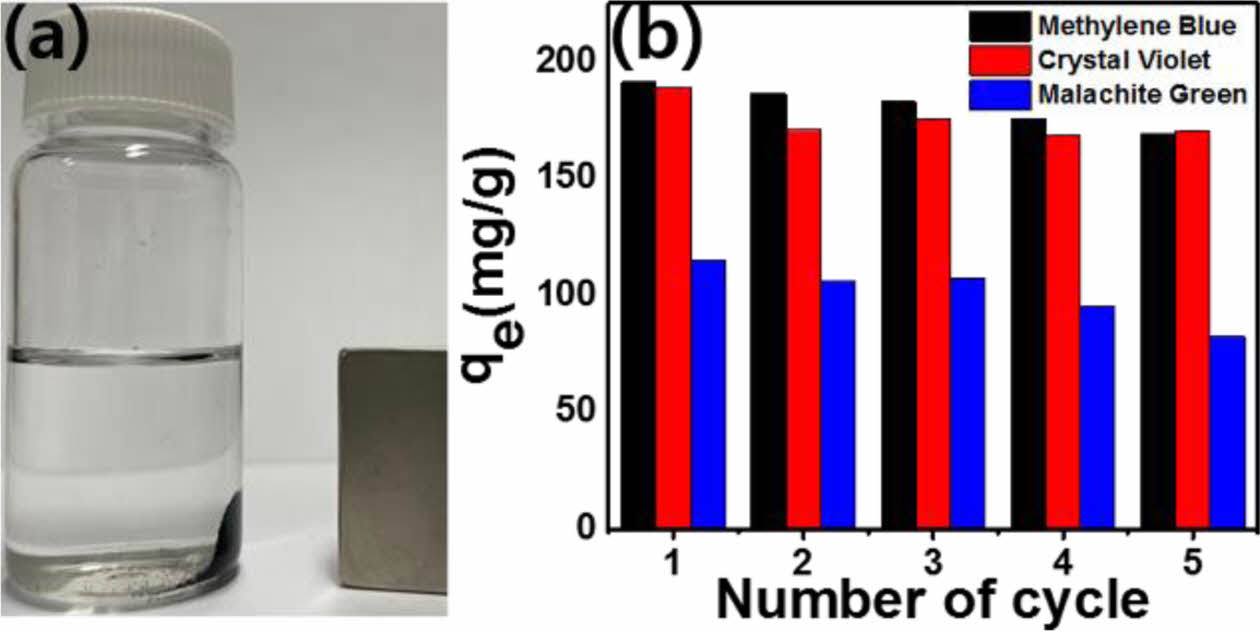
염료 흡착 후 마이크로겔의 회수 및 흡착된 염료의 탈착을 통한 재사용을 위해 겔 내부에 산화철을 분산시켜 제조하였다. 산화철이 분산된 겔은 외부 자기장에 노출되었을 때 Fig. 8a와 같이 자석이 있는 방향으로 이동하게 된다. 마이크로겔의 실제 적용 가능성을 확인하기 위해 흡착제의 재사용 성능 평가는 중요한 요소이며 이를 확인하기 위해 흡∙탈착 실험을 진행하였다. 탈착은 흡착 후 겔을 0.1M의 HCl에 3시간동안 담가 진행하였으며 Fig. 8b와 같이, 5회의 흡∙탈착 실험 진행 후 MB에 대한 겔의 흡착성능은 191.1에서 169.1 mg/g으로 감소하였다. 탈착 후 표면의 잔류 염료는 겔 표면의 일부를 점유하여 초기 흡착 공정에 비해 흡착성능이 감소한다. 그럼에도 불구하고, 재사용 겔의 흡착성능은 모든 염료에서 70% 이상의 성능을 유지하고 있어 실용화 가능성을 확인할 수 있었다[16].
|
Fig. 1 (a) Schematic illustration of the microfluidic device for the preparation of W/O/W double emulsion drops. (b) Cartoons showing the procedure of magnetic microgel production by osmotic pressure |
|
Fig. 2 OM images from double emulsions to microgels: (a) double emulsion drops, (b) shrinkage of the double emulsion drops under hypertonic conditions, and (c) microgels obtained by oil shell rupture |
|
Fig. 3 FTIR spectra of GO/PVA powder mixture and GO/PVA/ Fe3O4 composite microgels |
|
Fig. 4 UV-VIS spectra for dye adsorption from aqueous solutions using gels: (a) methylene blue, (b) crystal violet, and (c) malachite green at various time intervals |
|
Fig. 5 (a) Effect of initial concentration of MB, CV and MG adsorption capacity of microgels (initial dye concentration ranging from 100 to 3000 mg/L, solution pH 6, dose 0.05 g, room temperature for 3 h). (b) Time profiles of MB, CV, and MG adsorption onto gels (initial dye concentration 3000 mg/L, solution pH 6, dose 0.05 g, room temperature for 3 h). (c) Adsorption of dye on gels as a function of pH (initial dye concentration 3000 mg/L, solution pH ranging from 2.0 to 10.0, dose 0.05 g, room temperature for 3 h) |
|
Fig. 6 Adsorption isotherm models for MB, CV, and MG onto microgels: (a) Langmuir isotherm model and (b) Freundlich isotherm model (dye concentration range 100-3000 mg/L, solution pH 6, dose 0.05 g, room temperature, and 3 hours) |
|
Fig. 7 Fitting of kinetic models for adsorption of MB, CV, and MG onto microgels: (a) pseudo-first-order model and (b) pseudo-second-order model (initial dye concentration 3000 mg/L, solution pH 6, dose 0.05 g, and room temperature) |
|
Fig. 8 (a) Photograph of magnetic microgels responsive to a magnet. (b) Cyclic efficiency of adsorption behavior after desorption up to five cycles for each dye |
|
Table 1 Calculated parameters of adsorption equilibrium isotherms for each dye onto microgels |
본 연구에서는 미세유체 시스템과 삼투압법을 이용한 간단한 공정으로 회수 및 재사용이 가능한 자성 마이크로겔 제조에 대해 설명하였고, 더 나아가 이렇게 제조된 자성 마이크로겔의 우수한 염료 흡착성능을 증명하였다. 음이온전하를 띄는 겔 표면에 의해 양이온성 염료(MB, CV, MG)에 대한 흡착성능이 우수하였으며, 메틸렌 블루에서 가장 높은 성능(191.1 mg/g)을 나타내었다. 또한, 염료의 pH에 따른 흡착성능은 염료에 존재하는 atomic nitrogen 이온(N+)과 양이온(H+)의 마이크겔 표면에 대한 흡착경쟁이 pH가 증가할수록 감소하기 때문에 pH 10의 조건에서 모든 염료에 대한 마이크로겔의 흡착성능이 가장 우수하였으며, 특히, 메틸렌 블루에 대한 흡착성능(231.6 mg/g)이 가장 높게 측정되었다. 또한, 염료에 대한 자성 마이크로겔의 흡착 거동은 등온흡착 분석을 통해 Langmuir 등온선의 일치도가 높아 균일한 단분자층 흡착임을 확인하였고, 동역학 분석을 통해 유사 2차 반응에 높은 일치도를 나타내어 화학흡착에 가깝다는 것을 확인하였다. 자석을 이용한 자성 마이크로겔의 회수와 재사용 성능평가를 통해 회수의 용이성과 흡착성능은 모든 염료에서 재사용하는 5회동안 70% 이상이라는 높은 성능 유지를 관찰할 수 있었다.
이는 기존의 벌크공정에서 해결하지 못한 회수 및 재사용의 어려움과 흡착 후 수용액 상에 남아있는 흡착제의 2차오염 유발이라는 문제점을 손쉽게 해결할 수 있는 기술이며 더 나아가 실생활에서의 적용가능성을 확인하였다.
본 연구는 교육부의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업(NRF-2020R1I1A306849711)과 중소벤처기업부의 지원을 받아 수행된 맞춤형 기술파트너 지원사업(s3119826)의 연구과제로 수행된 것이며, 지원에 대해 감사드립니다.
- 1. Gil, T.H., Lee, W.H., and Ahn, J.-H., “Adsorption of Methylene Blue from Aqueous Solution by Pumpkin-Seed Residue,” Korean Society of Environmental Engineers, Vol. 42, No. 1, 2020, pp.10-18.
-

- 2. Katheresan, V., Kansedo, J., and Lau, S.Y., “Efficiency of Various Recent Wastewater Dye Removal Methods: A Review,” Journal of Environmental Chemical Engineering, Vol. 6, No. 4, 2018, pp. 4676-4697.
-

- 3. Lee, J.J., “Isotherm, Kinetic, Thermodynamic and Competitive for Adsorption of Brilliant Green and Quinoline Yellow Dyes by Activated Carbon,” Korean Chemical Engineering Research, Vol. 59, No. 4, 2021, pp. 565-573.
-

- 4. Hussain, S., Kamran, M., Khan, S.A., Shaheen, K., Shah, Z., Suo, H., Khan, Q., Shah, A.B., Rehman, W.U., Al-Ghamdi, Y.O., and Ghani, U., “Adsorption, Kinetics and Thermodynamics Studies of Methyl Orange Dye Sequestration Through Chitosan Composites Films”, International Journal of Biological Macromolecules, Vol. 168, 2021, pp. 383-394.
-

- 5. Cheng, Z., Liao, J., He, B., Zhang, F., Zhang, F., Huang, X., and Zhou, L., “One-step Fabrication of Graphene Oxide Enhanced Magnetic Composite Gel for Highly Efficient Dye Adsorption and Catalysis,” ACS Sustainable Chemistry & Engineering, Vol. 3, No. 7, 2015, pp. 1677-1685.
-

- 6. Mani, S.K., and Bhandari, R., “Microwave-assisted Synthesis of Self-assembled Network of Graphene Oxide-Polyethylenimine-Polyvinyl Alcohol Hydrogel Beads for Removal of Cationic and Anionic Dyes from Wastewater,” Journal of Molecular Liquids, Vol. 345, 2022, pp. 117809.
-

- 7. Han, M., Xu, B., Zhang, M., Yao, J., Li, Q., Chen, W., and Zhou, W., “Preparation of Biologically Reduced Graphene Oxide-based Aerogel and Its Application in Dye Adsorption,” Science of the Total Environment, Vol. 783, 2021, 147028.
-

- 8. Choi, Y.H., Lee, S.S., Lee, D.M., Jeong, H.S., and Kim, S.H., “Composite Microgels Created by Complexation between Polyvinyl Alcohol and Graphene Oxide in Compressed Double‐Emulsion Drops,” Small, Vol. 16, No. 9, 2020, pp. 1903812.
-

- 9. Chang, Z., Chen, Y., Tang, S., Yang, J., Chen, Y., Chen, S., Li, P., and Yang, Z., “Construction of Chitosan/polyacrylate/graphene Oxide Composite Physical Hydrogel by Semi-dissolution/acidification/sol-gel Transition Method and Its Simultaneous Cationic and Anionic Dye Adsorption Properties,” Carbohydrate polymers, Vol. 229, 2020, pp. 115431.
-

- 10. Mittal, H., Al Alili, A., Morajkar, P.P., and Alhassan, S.M., “Graphene Oxide Crosslinked Hydrogel Nanocomposites of Xanthan Gum for the Adsorption of Crystal Violet Dye,” Journal of Molecular Liquids, Vol. 323, 2021, pp. 115034.
-

- 11. Guo, H., Jiao, T., Zhang, Q., Guo, W., Peng, Q., and Yan, X. “Preparation of Graphene Oxide-based Hydrogels as Efficient Dye Adsorbents for Wastewater Treatment,” Nanoscale Research Letters, Vol. 10, No. 1, 2015, pp. 1-10.
-

- 12. Wang, N., Chang, P.R., Zheng, P., and Ma, X., “Graphene–poly (vinyl alcohol) Composites: Fabrication, Adsorption and Electrochemical Properties,” Applied Surface Science, Vol. 314, 2014, pp. 815-821.
-

- 13. Lee, J.J., “Characteristics of Isotherm, Kinetic and Thermodynamic Parameters for the Adsorption of Acid Red 66 by Activated Carbon,” Clean Technology, Vol. 26, No. 1, 2020, pp. 30-38.
-

- 14. Cho, S., “Fabrication of Functional Microcapsules Using Microfluidic Approach and Their Application to Heavy Metal Ions Adsorption,” MS Thesis, Chonnam National University, KR, 2021.
- 15. Cho, S., Kim, J.H., Yang, K.S., and Chang, M., “Facile Preparation of Amino-functionalized Polymeric Microcapsules as Efficient Adsorbent for Heavy Metal Ions Removal,” Chemical Engineering Journal, Vol. 425, 2021, pp. 130645.
-

- 16. Sun, L., Wang, J., Yu, Y., Bian, F., Zou, M., and Zhao, Y., “Graphene Oxide Hydrogel Particles from Microfluidics for Oil Decontamination,” Journal of Colloid and Interface Science, Vol. 528, 2018, pp. 372-378.
-

 This Article
This Article
-
2022; 35(2): 98-105
Published on Apr 30, 2022
- 10.7234/composres.2022.35.2.098
- Received on Feb 10, 2022
- Accepted on Feb 24, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Changhun Yun, Mincheol Chang
-
* Department of Polymer Engineering, Graduate School, Chonnam National University, Gwangju 61186, Korea
** School of Polymer Science and Engineering, Chonnam National University, Gwangju 61186, Korea - E-mail:






 Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.
Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.